第一节 补体系统的组成和性质
补体(complement,C)是存在于人和脊椎动物血清及组织液中的一组具有酶样活性的球蛋白,加上其调节因子和相关膜蛋白共同组成一个反应系统枣补体系统。补体系统参与机体的抗感染及免疫调节,也可介导病理性反应,是体内重要的免疫效应系统和放大系统。
(一)补体系统的组分及命名
补体系统包括30余种活性成分,按其性质和功能可以分为三大类:①在体液中参与补体活化级联反应的各种固有成分;②以可溶性形式或膜结合形式存在的各种补体调节蛋白;③结合补体片段或调节补体生物效应的各种受体。
1968年WHO命名委员会对补体系统进行了统一命名。参与补体激活经典途径的固有成分按其被发现的先后顺序分别称为C1、C2、……C9,C1由C1q、C1r、C1s三种亚单位组成;补体系统的其他成分以英文大写字母表示,如B因子、D因子、P因子、H因子等;补体调节成分多以其功能进行命名,如C1抑制物、C4结合蛋白、衰变加速因子等;补体活化后的裂解片段以该成分的符号后面加小写英文字母表示,如C3a、C3b等;具有酶活性成分或复合物在其符号上划一横线表示,如C1、C3bBb等;灭活的补体片段在其符号前面加英文字母i表示,如iC3b等。
(二)补体组分的理化性质
补体的大多数组分都是糖蛋白,且多属于β球蛋白;C1q、C8等为γ球蛋白,C1s、C9为α球蛋白。正常血清中各组成分的含量相差较大,C3含量最多,C2最低。各种属动物间血中补体含量也不相同,豚鼠血情中含有丰富的补体,故实验室多采用豚鼠血作为补体来源。
补体性质不稳定,易受各种理化因素影响,例如加热65℃30min即被灭活。另外紫外线照射、机械振荡或某些添加剂等理化因素均可能破坏补体。所以补体活性检测标本应尽快地进行测定,以免补体失活。补体系统各组成分的主要理化性质见表3-1。
表3-1 补体成分及其主要理化性质
| 分子量(kD) | 血清浓度(μg/ml) | 电泳位置 | 肽链数目 | |
| 经典途径成分 | ||||
| C1q | 410 | 75 | γ | 18 |
| C1r | 85 | 50 | β | 1 |
| C1s | 85 | 50 | α[XB]2[/XB] | 1 |
| C4 | 210 | 200~500 | β[XB]1[/XB] | 3 |
| C2 | 110 | 20 | β[XB]1[/XB] | 1 |
| C3 | 195 | 550~1200 | β[XB]1[/XB] | 2 |
| C5 | 19 | 70 | β[XB]1[/XB] | 2 |
| C6 | 128 | 60 | β[XB]2[/XB] | 2 |
| C7 | 121 | 60 | β[XB]2[/XB] | 1 |
| C8 | 155 | 60 | γ | 1 |
| C9 | 79 | 60 | α | 1 |
| 替代途径成分 | ||||
| B因子 | 93 | 200 | β[XB]1[/XB] | 1 |
| D因子 | 25 | 1~2 | α | 1 |
| 备解素 | 220 | 25 | γ | 1 |
| 可溶性调节蛋白 | ||||
| C1抑制物 | 104 | 200 | α[XB]2[/XB] | 1 |
| I因子 | 88 | 35 | β | 2 |
| H因子 | 150 | 480 | β | 1 |
| S蛋白 | 8.3 | 505 | β | 1 |
| Sp40/40 | 0.08 | 50 | α | 2 |
| C4结合蛋白(C4Bp) | 550 | 250 | γ | 8或10 |
| 过敏毒素灭活因子 | 300 | α | ||
| 膜结合调节蛋白 | ||||
| 促衰变因子(DAF) | 70 | 1 | ||
| 膜辅助蛋白(MCP) | 45~70 | 1 | ||
| 同种限制因子 | 65 | |||
| 膜反应溶解抑制因子 | 18 |
(三)补体成分的分子结构
1.C1 是由C1q、C1r、C1s三个糖蛋白亚单位组成,有Ca[SB]2+[/SB]存在时形成巨分子复合体,病理状态下可有单体形式存在。C1q是补体成分中最大的分子,分子量为410kD,化学组成为胶原蛋白,由18条多肽链组成,肽链间借二硫键相连接,多肽链的末端呈球形,每3条不同的多肽链(α,β,γ)组合在一起形成6个亚单位,可与6个IgG分子结合,其结合部位在球状的头部(图3-1)。
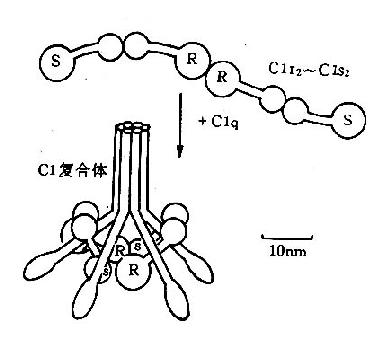
图3-1 C1分子模式图
C1r是一种β球蛋白,正常时以无活性的酶原样形式存在,有二条相同的非共价键连接的多肽链,C1r常与C1s紧密相联在一起,同时C1r还是C1q和C1s的联桥。C1s是一种α2球蛋白,单链,可被C1r激活,C1s具有酶样活性,在Mg[SB]2+[/SB]存在时激活C4和C2。
2.C4 是一种β球蛋白,由3条多肽链组成(α,β,γ),分子量分别是95kD、78kD和33kD。C1s可将3条链中最大的α链裂解,释放出一较小的多肽C4a,余下的大部分结合在靶细胞上,进行补体的下一步活化程序。
3.C2 是一种β球蛋白,单链,是血清中含量最少的补体成分。激活的C2极不稳定,易衰变,形成补体系统中的一种自身调节机制,以控制补体的激活过程。
4.C3 是一种β球蛋白,由α和β两条多肽链组成(图3-2),分子量分别是110kD和75kD。α链有998个氨基酸残基,β链有669个氨基酸残基;两链间以氢键、疏水键及二硫键相连,相互平行。α链参与C3活化,链的第77位精氨酸和78位丝氨酸之间的肽键是C3裂解酶的作用部位。C3裂解后产生小片段C3a和大片段C3b;C3b受H因子、I因子和CR1的协同作用降解为无活性的iC3b;iC3b可以被水解为C3c和C3dg,C3dg还可被进一步降解成C3d和C3g。
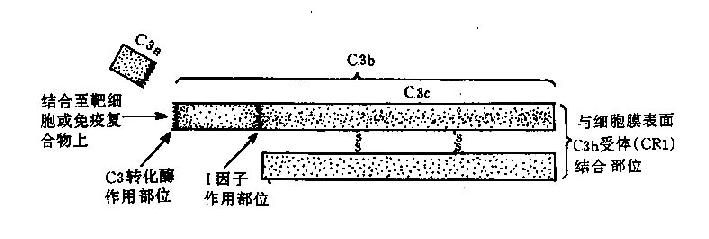
图3-2 C3分子及其裂解产物示意图
C3呈多样性,有30多种异构型。完整的C3分子含糖约2.2%,主要是甘露糖和岩藻糖。C3在血清中含量甚高,可达550~120μg/ml。C3是补体系统中起关键作用的一种成分,所有的补体激活途径均需C3的参与。
5.C5 是一种β球蛋白,由2条多肽链组成,与C3相似。α链被裂解后游离出一小分子具有特殊生物活性的C3a,其余大部分片段C5b参与后续的补体活化。
(四)补体的细胞受体
补体受体(complement receptor,CR)是细胞膜上能与补体成分或补体片段特异性结合的一种表面糖蛋白。许多类型的细胞膜上都具有补体受体,而且在同一细胞膜上可含有不同的受体。现将已发现的几种主要补体受体作简单介绍。
1.C1q受体 在中性粒细胞、单核细胞、多数B细胞等一些细胞的表面发现有C1q受体,该受体不与完整C1分子中的C1q相互作用,但C1被C1NH解离后则可结合C1q。受体在结合C1q后可活化各种细胞的相应功能,例如氧化代谢、吞噬功能及某些抗体非依赖性的细胞毒作用等。
2.C3受体 研究最多的是C3系列片段受体,最先命名的CR1~CR4都是C3片段的受体(表3-2)。这些受体不能识别循环中的C3分子,只选择性地结合C3裂解后的片段;而且这种结合作用不能被正常血浆蛋白所封闭。不同片段的受体分布于不同类型的细胞,以CR1(C3b受体)的分布较广,可发现在人类红细胞、中性粒细胞、单核-巨噬细胞和B细胞上;CR2(C3d受体)只表达在淋巴母细胞及淋巴细胞上;而CR3(iC3b受体)只表达在吞噬细胞上。
如果C3片段结合在抗原抗体复合物上,则C3受体就是抗原与细胞结合的桥梁;如果结合到吞噬细胞表面,则将促进吞噬细胞对抗原的吞噬,故CR1和CR3均是吞噬过程中的重要物质。同时,CR1和CR2均是血清酶I因子裂解C3片段的协同因子;CR3和CR4还是整合素(integrin)家族的成员,在细胞吸附过程中具有重要作用;CR3缺乏患者血中的吞噬细胞的吸附和吞噬功能明显异常,经常性软组织及皮肤感染,特别是链球菌和铜绿假单胞菌感染。
表3-2 C3片段的细胞受体
| 受体 | 蛋白结构 | 结合片段 | 分布细胞 | 主要功能 |
| CR1 | 单链15~40kD | C4b/C3b iC3b | 红细胞,吞噬细胞,嗜酸性粒细胞等 | 促吞噬作用,辅助裂解C3b成C3dg |
| CR2 | 单链140kD | C3d | B细胞,少数其他淋巴细胞 | B细胞分化,EB病毒受体 |
| CR3 | 双链265kD | iC3d | 吞噬细胞 | 促吞噬,辅助C3bi降解 |
| CR4 | 双链254kD | iC3b,C3d | 枯否细胞,其他吞噬细胞 | 不详 |
| C3aR | ? | C3a,C4a | MN,T-C,平骨肌,肥大细胞单核细胞等 | 免疫调节,过敏毒素 |
| C3eR | ? | C3e | 中性粒细胞 | 引起骨髓中PMNS释放 |
补体的可溶性调节蛋白和细胞膜相关蛋白是补体系统的重要组成部分,其主要成分的理化性质见表3-1;对补体活化的调节作用见表3-3。