第二节 粘附分子的表达的调节
,,。、,,。(),,/、-、--,,(- -)。(-),,,-、-。,。
一、粘附分子构型改变影响细胞的粘附作用
<>,,,。 <><>()- <>,,、、、Ⅱ,,-/-,。--,-/-,。,,-/,。 <>.-- --,。--,-,。--,-。-,,-。,-:()-,-,-();()-,-,-;()-,-。-,-,、、-,-,-(-,-)。-()。 <>,-,-、,--,--,-。 <>
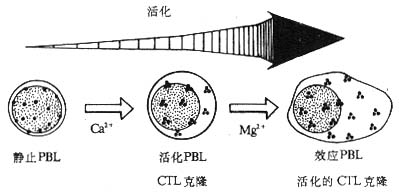 <>- -
<>:()[]+[/];[]+[/]。。
<>- -
<><><><> <><>-<><>-<><>-<><>-<><><><><>-<><><><><>-<><><><><>-<><><><><>-β()<><><>
<>.[]+[/]、[]+[/]-[]+[/][]+[/]-,()[]+[/][]+[/]-。-,[]+[/][]+[/]-,-。-[]+[/];()-、-、,[]+[/]。,,。,、-、-,[]+[/];、-Ⅱ,[]+[/][]+[/]。
<>
<>- -
<>:()[]+[/];[]+[/]。。
<>- -
<><><><> <><>-<><>-<><>-<><>-<><><><><>-<><><><><>-<><><><><>-<><><><><>-β()<><><>
<>.[]+[/]、[]+[/]-[]+[/][]+[/]-,()[]+[/][]+[/]-。-,[]+[/][]+[/]-,-。-[]+[/];()-、-、,[]+[/]。,,。,、-、-,[]+[/];、-Ⅱ,[]+[/][]+[/]。
<>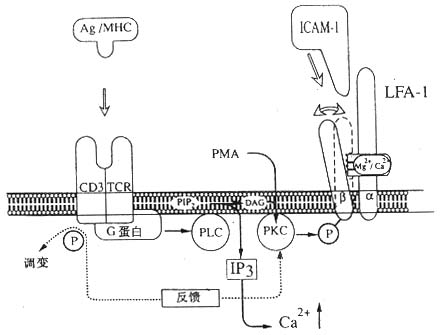 <>- -
<>:/,,-β,-,。/,,-β。
<>.- -。,,()-β,-。,,-,、-(-)。,。,,。-,--,、,--。-,-,-。
<><>()
<>-,。、-(/)、-(/)-(/)(),-,。-(/)ⅡⅢ(/),,。
<>,----,,。
<>- -
<>:/,,-β,-,。/,,-β。
<>.- -。,,()-β,-。,,-,、-(-)。,。,,。-,--,、,--。-,-,-。
<><>()
<>-,。、-(/)、-(/)-(/)(),-,。-(/)ⅡⅢ(/),,。
<>,----,,。
二、细胞粘附分子表达数量改变对粘附作用的调节
<>。,,。,。 <>. 。,,。,;/、/,、、-。,,。-、-α-、-,,。 <>.、 -、-、-、-、、-、-α、-β-γ、/,(-)。,,。 <>.、 、,、、。,,,。,、。,,( ),( )、-、、-,- 。 <>- 、 <><><><><><><><>-<><>-↑、-↑、-↑<><> <><>-↑<><> <><>/↑、、↑<><>-α、-β<><>-↑、-↑、-↑<><> <><>/↑、/↑<><>-<><>/↑<><>-<><>-↑<><>-γ<><>-↑、-↑-Ⅱ↑<><>、-、 -<><>-↓、/↑<><>、<><>↑<><><><>↑ <>:↑(-)<>↓(-)
上一篇:第一节 粘附分子的种类和结构
下一篇:第三节 粘附分子的功能