第三节 粘附分子的功能
在体内,一种细胞可能同时表达多种粘附分子,一种粘附分子也可以表达于多种不同的组织细胞,而细胞间的相互粘附作用又可能由多对粘附分子受体/配体共同参与,单从某一对粘附分子的作用难于了解细胞粘附作用的全过程。本节着重从粘附分子参与的体内某些生理或病理过程来介绍粘附分子的功能,并简述其分子基础。
一、炎症过程中白细胞与血管内皮细胞的粘附
炎症过程的一个重要特征就是白细胞粘附、穿越血管内皮细胞,向炎症部位渗出。这一过程一个重要的分子基础是白细胞与血管内皮细胞粘附分子的相互作用,表2-7例举了参与这一过程的粘附分子。不同白细胞的渗出过程或渗出过程的不同阶段所涉及的粘附分子不尽相同。
1.不同粘附分子在粘附过程不同阶段所起的作用 在体内由于血液处于不断流动状态,白细胞与血管内皮细胞的粘附作用是在血液流动产生的切力作用下进行的,因此白细胞与血管内皮细胞的相互粘附作用有其特殊性。体内白细胞与血管内皮细胞的粘附作用包括白细胞沿血管壁流动的最初粘附作用,以及随后的加强粘附和穿越内皮细胞的过程。为了模拟体内血液流动状态,在体外研究白细胞与血管内皮细胞的粘附作用时,采用了特殊的实验装置,使培养液中的中性粒细胞不断流动通过培养状态的单层内皮细胞。实验表明,在流体产生的切力作用下,CD11/CD18与其配体ICAM-1对于中性粒细胞与血管内皮细胞的最初粘附几乎不起作用。相比之下,L-seletin分子与其配体E-selectin的结合则发挥重要的作用,抗L-selectin分子的单克隆抗体可明显阻断这种最初的粘附作用。在随后发生的中性粒细胞与血管内皮细胞加强粘附并穿越血管内皮细胞的过程中,L-selectin分子与其配体的结合则几乎不起任何作用,而CD11/CD18与其配体的相互作用上升到关键地位。已经粘附于血管内皮细胞的中性粒细胞L-selcetin分子表达水平显著下降,在趋化因子(如膜结合IL-8)的诱导下,CD11/CD18表达水平则明显升高。事实上,L-selectin分子表达下降可减少对已粘附中性粒细胞的牵拉作用,有利于CD11/CD18介导的中性粒细胞的穿越血管内皮细胞过程。
表2-7 参与白细胞与血管内皮细胞粘附的粘附分子
| 白细胞粘附分子(受体) | 主要表达细胞 | 内皮细胞的粘附分子(相应配体) |
| CD11a/CD18 | N.L.M | ICAM-1、ICAM-2、ICAM-3 |
| CD11b/CD18 | N.L.M | ICAM-1 |
| CD11c/CD18 | N.L.M | |
| VLA-4(CD49d/CD29) | L.M | ICAM-1 |
| l-selectin(CD62L) | N.L.M | E-selectin、P-selectin |
| CD15 | N | E-selectin、P-selectin |
注:N:中性粒细胞 L:淋巴细胞 M:单核细胞
2.膜结合细胞因子在白细胞与血管内皮细胞粘附过程中所起的作用 调节上述白细胞粘附分子表达的细胞因子有血管内皮细胞膜表面结合的IL-8、GM-CSF、PAF等对中性粒细胞具有趋化作用的细胞因子,血管内皮细胞所合成的上述细胞因子主要以膜结合(membrane-bound)的形成表达于血管内皮细胞表面。中性粒细胞与血管内皮细胞的粘附过程是在血管内皮细胞膜结合细胞因子调节作用下多种粘附分子按顺序协调作用的复杂过程(图2-12)。
在中性粒细胞粘附、穿越血管内皮细胞的过程中,IL-8、GM-CSF和PAF等细胞因子发挥着关键的调节作用,没有上述细胞因子的作用,最初粘附到血管内皮细胞的中性粒细胞可能重新回到血流中去。膜结合细胞因子的存在作用其特殊意义,它可以使细胞因子的作用局限化,促进白细胞的粘附、渗出、游离的细胞因子(IL-8等)作用于白细胞减少其L-selectin分子的表达,反而抑制白细胞的粘附、渗出。血管内皮细胞表面不同的膜结合细胞因子不同白细胞粘附作用的选择性激活可能是选择白细胞粘附、渗出过程的因素之一。
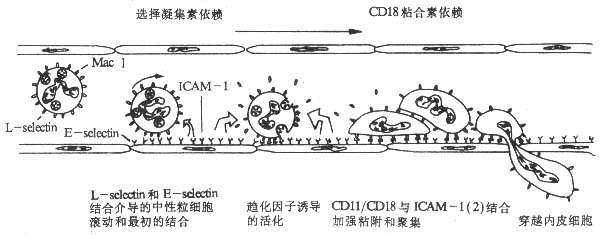
图2-12 中性粒细胞粘附、穿越血管内皮细胞过程的模式图
淋巴细胞的粘附、渗出过程可能采取相似的方式,只是所涉及的粘附分子及粘附激活机制有所不同。即最初是由seectin分子介导的淋巴细胞与血管内皮细胞的不稳定的粘附,随后血管内皮细胞的膜结合细胞因子作用于淋巴细胞激活其integrin分子,导致加强粘附及穿越血管内皮细胞的过程。
粘附分子在白细胞渗出过程中的重要作用在先天性白细胞粘附缺陷症(leukocyte adhesion deficiency,LAD)发病机理中得到了证实。该病的临床特征是反复发生难以治愈的感染。LAD可分为LAD-1和LAD-2两型。LAD-1型患者白细胞CD11/CD18分子表达缺陷,因此不能与FN和C3bi结合,丧失非特异的调理作用;此外,虽然白细胞可以沿血管壁流动,由于不能与血管内皮细胞表面粘附分子ICAM-1结合,白细胞不能渗出到炎症部位。LAD-2型患者白细胞S-Lewis[SB]x[/SB](CD15s)表达缺陷,不能有效的与E-selectin分子结合,白细胞沿血管壁的流动能力显著低于正常人,同样也不能向炎症部位渗出。因此阻断白细胞与血管内皮细胞的粘附和白细胞的渗出有可能成为预防和治疗性疾病的一种新的手段。
3.细胞因子在白细胞选择性渗出过程中的作用 不同炎症具有不同类型的炎细胞浸泣,如急性炎症以中性粒细胞渗出和浸润为主,慢性炎症往往以淋巴细胞浸润为主,Ⅰ型超敏反应的变态反应性炎症以嗜碱性粒细胞的选择性渗出为主,迟发型超敏反应性炎症则以单核细胞、T细胞浸润为特征。虽然目前对白细胞选择性渗出的机理还不完全明了,但已有的证据显示粘附分子在不同类型白细胞表达的差异以及细胞因子对粘附分子表达的不同调节作用可能是重要的因素。如IL-4和IFN-γ作用于血管内皮细胞可以选择性地诱导粘附性粒细胞表达,在中性粒细胞不表达,因此IL-4和IL-4和IFN-γ可以选择性的促进除中性粒细胞以外的白细胞的粘附作用。IL-4和IFN-γ是由活化T淋巴细胞产生的细胞因子,炎症局部活化T淋巴细胞可能通过产生IL-4和IFN-γ等细胞因子作用于局部血管内皮细胞,促进白细胞的渗出,因此IL-4和IFN-γ可能在免疫介导的炎症性疾病中发挥重要作用。此外,IL-8、GM-CSF和PAF等膜结合细胞因子也可能是导致白细胞选择性渗出的重要因素。
二、粘附分子与淋巴细胞的归巢
淋巴细胞在中枢淋巴器官发育成熟后,经血流定居在外周淋巴器官,并在全身和器官、组织以及炎症部位发挥多种生物学功能。淋巴细胞归巢(homing)是淋巴细胞迁移的一种特殊形式,包括:(1)淋巴干细胞向中枢淋巴器官的归巢(2)淋巴细胞向外周淋巴器官的归巢;(3)淋巴细胞再循环,即外周淋巴器官的淋巴细胞通过毛细血管后静脉进入淋巴循环,以利于免疫细胞接触外来抗原,然后再回到血循环;(4)淋巴细胞向炎症部位的渗出。淋巴细胞是一个不均一的群体,可以分为不同的群或亚群。淋巴细胞归巢过程的一个显着特点是不同群或亚群的淋巴细胞在上述移行过程中具有相对的选择性,即某一特定的淋巴细胞群或亚群定向归巢到相应的组织或器官。淋巴细胞归巢过程的分子基础是淋巴细胞与各组织、器官血管内皮细胞粘附分子的相互作用。一般将淋巴细胞的粘附分子称为淋巴细胞归巢受体(lymphocyte homing receptor,LHR),而将其对应的血管内皮细胞的粘附分子称为地址素(addressin)。多种粘附分子与淋巴细胞的归巢有关(表2-8),但参与不同群或亚群淋巴细胞归巢过程的粘附分子是不同的,成为淋巴细胞选择性归巢的分子基础。
(一)T细胞前体向胸腺的归巢
对于骨髓产生的T细胞前体(Pro-T cell)向胸腺归位的机理尚缺乏深入的研究。目前已知T细胞祖细胞表达CD44与L-selectin分子,它们可能与T细胞祖细胞的归巢有关。此外,胸腺血管内皮细胞表达一种被称为EA1的分子,可能起到地址素的作用参与T细胞的归巢过程。最近认为integrin中α6β1、α6β4对T细胞前体的粘附起重要作用。
(二)淋巴细胞向外周淋巴器官的归巢
淋巴细胞向外周淋巴器官的归巢主要有淋巴细胞向外周淋巴结、派伊尔小结(Peyre's Patch)及脾脏的选择性归巢等几种不同的途径。
1.淋巴细胞向外周淋巴结的归巢 L-selectin是决定淋巴细胞向外周淋巴结选择性归巢的归巢受体,其相应配体为特异性表达于外周淋巴结血管地址素(perpheral lymphonode vascular addressin,PNAd)。L-selectin分子与PNAd相结合介导了淋巴细胞与外周淋巴结血管内皮细胞最初的粘附,随后参与粘附与穿越过程的粘附分子主要有LFA-1/ICAM-1、ICAM-2及CD44/MAd分子。
2.淋巴细胞向派伊尔小结的归巢 integrinα4β7分子是淋巴细胞向派伊尔小结定向归巢的特异归巢受体,抗α4β7的抗体可特异性地阻断淋巴细胞向派伊尔小结的归巢过程,而对淋巴细胞向外周淋巴结的归巢过程无明显影响。integrin α4亚单位可与β1、β2、βρ等β亚单位结合,分别组成α4β1、α4β7和α4βρ,并表达在不同的淋巴细胞表面,可能与特定淋巴细胞群或亚群的定向归巢有关。派伊尔小结的静脉高内皮细胞专一的、高水平表达粘膜血管地址素(mucosal vascular addressin,MAd).MAd是一种分子量为60kDa的糖蛋白,其对应的淋巴细胞归巢受体是integrin α4β7,两者的相互作用构成了特定淋巴细胞群向派伊尔小结定向归巢的基础。CD44及LFA-1分子作为淋巴细胞归巢受体与其配体MAd和ICAM-1、ICAM-2的相互作用也参与淋巴细胞向派伊尔小结的归巢过程,但它们与α4β不同,除参与淋巴细胞向派伊尔小结归巢外,还参加向其它外周淋巴器官的归巢。
表2-8 参与淋巴细胞归巢的粘附分子
| 表达于淋巴细胞的归巢受体 (lymphocyte homing receptor) | 血管内皮细胞的相应地址素 (addressins) | ||
| 粘附分子 | 作用 | 粘附分子 | 作用 |
| L-selecten | 淋巴细胞向外周淋巴器官的归巢 | PNDd | 外周淋巴结高静脉内皮细胞的地址素 |
| CLA | 定向归巢于皮肤的记忆T细胞表面的归巢受体 | E-selectin | 表达在皮肤炎症部位的血管内皮细胞 |
| LFA-1 | 参与多种淋巴细胞归巢过程 | ICAM-1、ICAM-2 | 参与多种淋巴细胞的归巢过程 |
| VLA-4 | 淋巴细胞归巢受体 | VCAM-1 | 表达于炎症部位血管内皮细胞 |
| CD44 | 参与多种淋巴细胞归巢受体 | MAd | 肠道淋巴组织及粘膜固有层血 |
| integrin | 定向归位于派伊尔小结的淋巴细胞的归巢受体 | MAd | 管内皮细胞的地址素 |
| α4β7 | |||
淋巴细胞向脾脏的归巢过程也是特定淋巴细胞群的定向归巢过程,但其归巢机理与分子基础尚不清楚。
(三)淋巴细胞向非淋巴组织的归巢
正常的非淋巴组织没有或只有少量淋巴细胞,但在炎症状态下,淋巴细胞可以大量浸润。淋巴细胞向非淋巴组织的归巢可以区分为以下两种情况:(1)正常的皮肤及消化、生殖道粘膜组织中有特定表达γδ型T细胞受体(TCRγδ)的淋巴细胞群存在,它们可能直接来自中枢淋巴器官,这些淋巴细胞的归巢过程所涉及的粘附分子还不清楚。此外,正常皮肤或粘膜等组织中经常存在有少量记忆淋巴细胞,可能是少量抗原持续刺激的结果。(2)淋巴细胞向炎症状态下的非淋巴组织的归巢。在炎症组织中浸润的淋巴细胞多为记忆性T细胞,这些T细胞表达较高水平的CD45RO,此外,LFA-1、ICAM-1,α4-integrin、LFA-3,CD44等粘附分子的表达也明显高于天然(naive)T淋巴细胞。上述粘附分子相对高表达可能与记忆T细胞向炎症部位的选择性渗出有关。
淋巴细胞向非淋巴组织的归巢过程除了具有记忆T细胞的选择性外,还有组织特异性,也就是就特定的淋巴细胞群选择性的定向归巢到皮肤、粘膜或滑膜等组织。
1.淋巴细胞向皮肤炎症部位的归巢 皮肤炎症部位的血管内皮细胞表达高水平的E-selectin分子,而向皮肤炎症部位定位归巢的记忆T细胞则表达皮肤淋巴细胞相关抗原(cutaneouslymphocyte-associated antigen,CLA),E-selectin与CLA的相互作用是CLA阳性记忆T细胞向皮肤炎症部位定向归巢的分子基础。此外,VLA-4与VCAM-1,LFA-1与ICAM-1/ICAM-2的相互作用也与淋巴细胞向皮肤炎症部位的归巢过程有关(参见表2-8)。
2.淋巴细胞向肠道粘膜炎症部位的归巢 目前关于这一过种的研究资料还不多。粘膜组织中的淋巴细胞表达一种称为MLA(mucosal lymphocyte antigen)的表面抗原,由integrin分子β7链与另一条不同于α4链的多肽链组成,可能与淋巴细胞向肠道粘膜的归巢过程有关。
3.淋巴细胞向滑膜炎症部位的归巢 目前已知LFA-1/ICAN-1、VLA-4/VCAM-1及CD44/MAd都参与淋巴细胞向滑膜组织的归巢过程,但还不能解释淋巴细胞向滑膜组织归巢过程的选择性。推测可能还有未被发现的决定淋巴细胞向滑膜组织定向归巢的粘附分子。
(四)淋巴细胞归巢过程中激活粘附作用的分子
前已述及,淋巴细胞的归巢与中性粒细胞渗出的过程是相似的。同样,淋巴细胞归巢过程中最初粘附后粘附作用的激活机制也与中性粒细胞的渗出过程类似。
1.具有趋化作用的多肽 巨噬细胞炎症蛋白-1(macrophageinflammatory protein-1,MIP-1)可以膜结合的形式存在于淋巴结或炎症组织血管内皮细胞表面,通过作用于CD8+T细胞使其与血管内皮细胞粘附作用增强,这种粘附作用的增强是由T细胞VLA-4与血管内皮细胞VCAM-1分子相互作用介导的。此外,趋化因子家族的RANTES对记忆T细胞具有选择趋化作用。不同的趋化多肽对特定淋巴细胞群粘附作用的激活可能与淋巴细胞的选择性归巢有关。
2.粘附分子介导的粘附激活作用 抗CD2和抗CD3单克隆抗体作用于T淋巴细胞可使T细胞表面integrin分子构型改变而使其与配体结合的亲和力增加。此外,淋巴细胞其它表面分子在与配体结合后可能通过相同或不同的机制影响粘附分子间相互结合的亲和力。可能具有上述作用的粘附分子有CD15、CD31和VLA-4。(1)抗CD15单克隆抗体与结合于LFA-1分子的CD15结合后,通过LFA-1分子构型的改变使其与ICAM-1粘附作用增强。血管内皮细胞表达的E-selectin分子可能模拟抗CD15单克隆抗体的作用,与CD15结合后导致淋巴细胞LEA-1与其配体ICAM-1粘附作用的激活。(2)抗CD31的单克隆抗体作用于CD8+T细胞可激活VLA-4/VCAM-1介导的粘附作用,淋巴细胞CD31分子与其血管内皮细胞配体的作用可能导致相同结果。(3)VLA-4与其配体VCAM-1结合对其自身的粘附具有正反馈调节作用。由于表达CD31的细胞多为天然T细胞,VLA-4的表达局限于部分T细胞,因此CD31和VLA-4对粘附作用的激活可能与不同的淋巴细胞群的定向归巢有关。
淋巴细胞的归巢是一个多种粘附分子参与并受各种因素调节的复杂过程,对于这一过程还缺乏系统的、确切的认识。随着免疫生物学和分子免疫学研究的进展,必将推动这一重要领域的深入研究,并为某些疾病的诊断、预防和治疗提供一条崭新的途径。
三、粘附分子参与免疫细胞的识别作用
免疫细胞的相互作用及杀伤细胞识别靶细胞的过程中,除了需要对特异性抗原的识别作用外,还需要粘附分子的相互作用。某些粘附分子的抗体可以阻断免疫细胞的相互作用及杀伤细胞对靶细胞的杀伤作用(图2-13)。辅助性T细胞与抗原提呈细胞的相互作用过程中,T细胞受体(TCR/CD3)识别抗原提呈细胞表面的特异性抗原与MHC分子的复合体,而CD4/MHC-Ⅱ类分子(非多态部分)、LFA-1/ICAM-1、LFA-2/LFA-3、CD28/CD80的相互作用则可以使两者紧密接触,提供了相互作用的重要条件,并参与T细胞的活化过程和细胞因子的分泌调节。杀伤性T细胞杀伤靶细胞(如病毒感染靶细胞)时,其CTL特异受体识别靶细胞抗原与MHC-Ⅰ类分子的复合物,CD8/MHC-Ⅰ类分子(非多态部分)、LFA-1/ICAM-1、LFA-2/LFA-3的相互作用导致效一靶紧密接触,杀伤细胞的细胞毒介质得以有效地发挥作用。值得注意的是无论是免疫细胞的相互作用或效-靶细胞的相互作用,最终相互接触的细胞仍然要分开,显然细胞内存在着对粘附作用的负反馈调节机制,尽管这种调节机制目前还不完全清楚,但已知CD3分子的表达下调可以激活PLC,可能导致LFA-1分子的去磷酸化而使其失去活性,降低LFA-1分子介导的粘附作用。
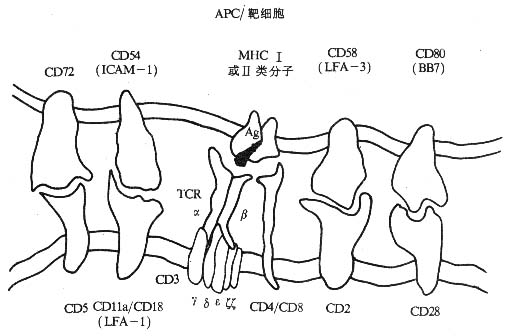
图2-13 粘附分子与免疫细胞的识别作用
四、粘附分子参与细胞发育、分化、附着及移动
在胚胎发育过程中,不同类型的细胞按着既定的规律形成细胞与细胞之间及细胞与细胞外基质的附着,有序地组合在一起构成不同的组织和器官。在这一过程中,粘附分子发挥着重要作用。
(一)粘附分子参与细胞间的附着
参与细胞与细胞间附着的粘附分子主要是Cadherin家族的粘附分子,以及属于免疫球蛋白超家族的粘附分子NCAM及CD31。已经发现,Cadherin分子是组织学上在细胞连接中起重要作用的粘着小带(zonula adherence)的重要跨膜万分。参与细胞与细胞间附着粘附分子的共同特点是以自身识别的方式相互作用,即相同的粘附分子之间的相互作用。如将转染了不同Cadherin cDNA的L细胞混合在一起后,表达相同Cadherin分子的L细胞可以重新聚集在一起。这种特殊的自身相互识别的作用方式保证了相同细胞的聚集。在胚胎发育过程中,细胞粘附分子的表达有规律的发生改变,支配不同细胞的有序组合形成组织和器官。当一群细胞失去其原来表达的Cadherin分子或获得表达一种新的Cadherin分子时,它可以离开原有的细胞群。而如果不同的细胞群的发育过程中的某一阶段表达某一种相同Cadherin分子,它们可以相互联系起来。如肺的间叶细胞表达N-Cadherin分子,而上皮细胞表达E-Cadherin和P-Cadherin分子,将肺组织胰酶消化后加入E-Cadherin cDNA转染的L细胞,则L细胞与上皮细胞聚集在一起。上述实验表明,Cadherin分子在胚胎发育、分化过程中可能起着重要的作用。
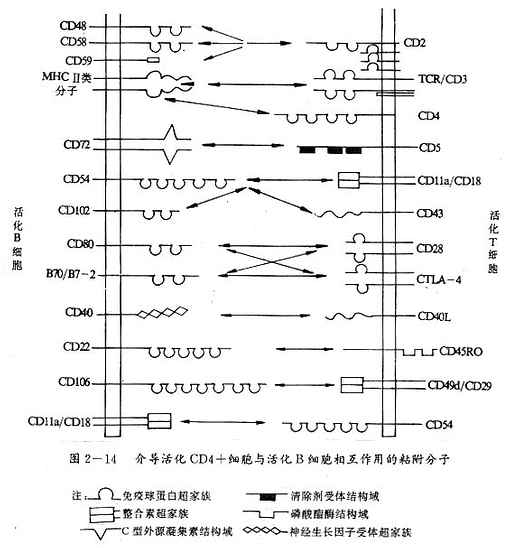
图2-14 介导活化CD4+细胞与活化B细胞相互作用的粘附分子
(二)粘附分子参与细胞与基质的附着
细胞与细胞间基质的附着是细胞生存与增殖所必需的,这种附着主要由integrinpe 家族的粘附分子来介导。除β2组外,integrin分子识别的配体大都是细胞外基质的成分,包括FN(fibronectin,纤粘连蛋白)、LM(lamnin,层粘连蛋白)、VN(Vitronecin,玻璃粘连蛋白)、CA(collagen,胶原蛋白)等。integrin分子广泛表达于各种组织细胞,而其配体广泛存在于细胞外基质中。细胞与基质的附着主要有以下两种情况:(1)间叶细胞,以成纤维细胞为代表,细胞的周围均与细胞外基质附着;(2)上皮细胞,细胞的周围部分与细胞外基质附着,而细胞侧面则是细胞之间的附着,在这种情况下细胞粘附分子的分布存在着极性,细胞癌变过程往往伴随着这种极性的丧失。
(三)粘附分子参与细胞的移动
在细胞发育、分化以及创伤修复过程中都需要细胞的移动,迄今为止对这一过程的确切机制还没有明确的认识,但可以肯定的是细胞粘附分子是这一过程的重要参与者,而且这些粘附分子的表达得到精细的调控。已经发现E-Cadherin、N-Cadherin、NCAM,CD31及FN和FN受体都与细胞移动有关。(1)在胚胎发育过程中,视神经轴突要沿着视束生长到达中脑顶盖建立突触联系,处于生长状态的轴突在神经表皮细胞表面移动,两者均表达N-Cadherin分子。如将胚胎的视网膜组织种植在单层不表达N-Cadherin的Neuro 2a细胞上,神经轴突不能生长;如果将Neuro 2a细胞转染N-Cadherin分子,则可以看到神经轴突的生长;抗N-Cadherin分子的抗体可以抑制轴突的生长。(2)FN及其受体的相互作用同样参与了胚胎发育中细胞的移动过程,含有RGD序列的多肽可以干扰胚胎发育中器官的发生。此外,FN及其受体还参与创伤修复过程中细胞的移动,FN可促进创面的愈合。(3)CD31则对细胞的移动具有抑制作用。
细胞粘附分子对细胞的移动具有促进与抑制两种作用,粘附分子在细胞表面分布的极性可能与其作用的差异有关。如CD31和E-Cadherin都分布在细胞的侧面与邻近细胞接触的部位,它们对细胞的移动具有抑制作用。
五、粘附分子与肿瘤
粘附分子与肿瘤的的关系主要包括对肿瘤浸润和转移的影响,对杀伤细胞杀伤肿瘤的影响,以及辅助肿瘤的诊断。
(一)粘附分子与肿瘤的浸润与转移
恶性肿瘤一个重要生物学特征是其对邻近正常组织的浸润及远处转移。目前已知肿瘤的浸润与转移与其粘附分子表达的改变有关。一方面肿瘤细胞某些粘附分子表达的减少可以使细胞间的附着减弱,肿瘤细胞脱离与周围细胞的附着,这是肿瘤浸润及转移的第一步;另一方面,肿瘤细胞表达的某些粘附分子使已入血的肿瘤细胞得以粘附血管内皮细胞,造成血行转移。
1.E-Cadherin与肿瘤浸润的关系 包括大肠癌、乳腺癌等在内的多种肿瘤细胞E-Cadherin分子表达明显减少或缺失,E-Cadherin分子表达水平降低与肿瘤细胞恶性程度显著相关。E-Cadherin分子在恶性程度低的乳腺癌细胞的表达水平明显高于恶性程度高的肿瘤细胞,而且其表达水平与腺小管形成成正比。体外实验更明确地证实了E-Cadherin分子与肿瘤浸润能力的关系。在培养状态下表达E-Cadherin分子的肿瘤细胞不侵入基附着的基质,但如加入抗E-Cadherin分子的抗体,则肿瘤细胞获得浸润能力;不表达E-Cadherin分子的肿瘤细胞在培养时表现浸润能力,但如将E-Cadherin分子的cD-NA转染肿瘤细胞使其表达E-Cadherin分子后,则肿瘤细胞丧失其浸润能力。
肿瘤细胞除粘附分子表达水平改变外,粘附分子在其表面的分布往往也有改变。E-Cadherin分子在正常的上皮组织中只分布于细胞相邻的侧面。而在某些上皮组织起源的肿瘤细胞E-Cadherin分子可以表达在细胞顶部。尽管某些肿瘤细胞可以表达一定水平的E-Cadherin分子,但分布的异常使其难以发挥细胞间附着的作用,这也可能与肿瘤的浸润与转移有关。
2.integrin家族与肿瘤浸润和转移的关系 integrin家族粘附分子在肿瘤细胞的表达水平也明显改变,既可表达数量减少或缺失,也可以表达升高,分布在极性亦可能不同于正常细胞。integrin分子在肿瘤细胞表达变化的不一致性可能与integrin分子的不同作用有关。同一种粘附分子可以在转移和附着两个不同的过程中发挥作用,因此integrin分子表达的增加或减少都可能与肿瘤细胞浸润及转移有关。
3.CD44和其它粘附分子对肿瘤转移的影响 与E-Cadherin分子对肿瘤浸润与转移的抑制作用相反,肿瘤细胞表达的某些粘附分子作为血管内皮细胞表面粘附分子、细胞外基质的相应受体可使已进入血流的肿瘤细胞粘附血管内皮细胞或基质,促进肿瘤细胞的转移。对肿瘤血行转移的研究多采用小鼠尾静脉注射黑素瘤细胞造成肺转移的模型,已知黑素瘤细胞表达的CD44分子、层粘连蛋白受体等都可以促进黑素瘤细胞有肺部形成转移灶,用相应粘附分子的抗体或可溶性配体则可减少黑素瘤的肺部形成转移灶。此外体内慢性炎症部位往往是肿瘤转移灶的好发部位,可能与炎症产物、细胞因子作用于局部血管内皮细胞促进其粘附分子表达而有利于肿瘤细胞的粘附有关。
不同的CD44分子在肿瘤浸润与转移过程中的作用可能是不同的,正常组织细胞或非转移的癌细胞主要表达CD44S,而具有转移能力的癌细胞主要表达CD44V。
(二)粘附分子对杀伤细胞杀伤肿瘤细胞的影响
杀伤细胞与肿瘤细胞的接触由两种细胞表面粘附分子的相互作用来介导,LFA-1/ICAM-1的相互作用具有重要地位。多种肿瘤细胞表达ICAM-1分子,肿瘤细胞ICAM-1分子的表达可能与肿瘤组织内淋巴细胞的浸润有关。细胞因子如IFN-γ、IFN-α、IL-4、TNF-α可促进某些肿瘤细胞ICAM-1分子的表达,从而增加其对杀伤细胞作用的敏感性。毛细胞白血病细胞不表达LFA-1和ICAM-1分子,使其对CTL的杀伤作用更为敏感。肿瘤患者血清中可溶性ICAM-1水平往往高于正常人,可能抑制NK对肿瘤细胞的杀伤作用。
(三)粘附分子与肿瘤的诊断
不同integrin分子在不同的组织、细胞有其特定的分布方式,虽然在肿瘤组织integrin分子的表达不同于正常组织,但仍在一定程度上保留了这种特定的分布方式,从而可以作为肿瘤分型诊断的参考依据。由于分化程度低的恶性肿瘤细胞在组织学上难以区分其组织来源,因此对其integrin分子表达的检测可以作为肿瘤诊断的一个有效的辅助手段。
正常的肝细胞表达VLA-α1和VLA-β1,而胆管上皮细胞表达VLA-α2、VLA-α3、VLA-α6和VLA-β4。肝癌包括肝细胞癌和胆管癌两种组织类型,分化良好的肝细胞癌和胆管癌表达integrin分子与其来源组织基本相似,但低分化的肝细胞癌可以表达VLA-α2、VLA-α3、VLA-α6。低分化的胆管癌细胞表达integrin分子的种类虽然与正常胆管相同,但表达数量明显减少。由于肝细胞癌不表达VLA-β4,而胆管癌细胞不表达VLA-α1,因此上述两种integrin分子可以作为区分两型肝癌的标志。
六、 粘附分子与凝血
凝血过程中血小板聚集的分子基础是血小板表面的粘附分子。在动脉和静脉中血小板聚集的机理有所差别,所涉及到的粘附分子也不尽相同。
动脉中形成的血栓主要由血小板组成,称为白血栓。动脉中血栓的形成过程包括最初血小板与血管壁损伤部位的接触、粘附及随后的活化、伸展和聚集。血小板与血管壁损伤部位的接触由血小板表面糖蛋白复合物GPIb-IX与管壁上的vWF因子(vonWillebrand facfor)的结合介导。GPIb-IX或vWF的遗传缺陷都可以导致病人凝血机能的障碍,在临床上分别被称为Bernard-Soulier综合征(Bernard-Soulier syndrome,BSs)和von Willebrand病(von Willebrand's disease,vWd)。
GPIb由一两条多肽链通过二硫键连接所组成,两条链分别称为GPIba(135kDa,CD42b)和GPIbβ(22kDa,CD42c),GPIb与另一个糖蛋白分子GPIX(23kDa,CD42a)按1:1的比例通过非共价键结合构成GPIb-IX复合物。GPIbα、GPIbβ和GPIX的共同特点是都含有不同数目的由24个氨a基酸构成的富含亮氨酸糖蛋白的重复序列段(leucine-rech glycoprotein,LRG)。BSs病人的血小板除缺乏GPIbα、GPIbβ、GPIX三种分子外,同时还缺乏另一条称为GPV的肽链。GPV同样含有LRG序列,其功能还不清楚。GPIb-IX复合物与vWF结合的部位在GPIbα链上,位于其N端的第7个LRG重复序列及近膜部分的富含碳水化合物区域之间(图2-15)。vWF可由血管内皮细胞和血小板合成,单体分子量为220kDa。血管内皮细胞可向其附着面分泌vWF,结合于基底膜的胶原纤维。
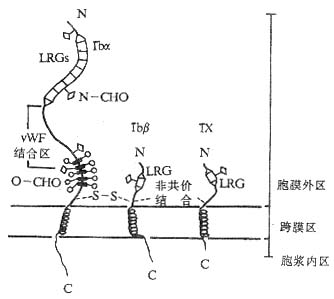
图2-15 GPIb-IX复合物的结构模式图
GPIb-IX与vWF结合的显著特点是切力依赖性(sheardependence),即GPIb-IX与vWF的结合只有动脉中血液快速流动状态下才会发生,在静脉血液流动缓慢或静止时GPIb-IX与vWF并不结合,目前对于这种切力依赖性结合发生的机理仍不清楚。
GPIb-IX与vWF的结合导致血小板的活化,使血小板糖蛋白GPⅡb-Ⅲa(αⅡbβ3)的构型发生改变,得以与血浆中vWF、FB、FN等配体结合,构成后续血小板的结合部位,触发血小板的聚集过程。另一种血小板糖蛋白GPⅠaⅡa(α2β1)可能也参与此过程。
(二)粘附分子与静脉凝血
静脉血栓形成过程中血小板起着较为次要的作用,血栓主要含有红细胞和纤维蛋白,称为红血栓,此过程与GPIb-IX和vWF的相互作用无关。血小板与血管壁的粘附可能由GPIaⅡa(α2β1)、GPIcⅡa(α5β1)αvβ3、GPⅡbⅢa(αⅡbβ3)等粘附分子共同介导,上述粘附分子的作用是切力非依赖性的。
七、粘附分子与细胞内信号传导
细胞间或细胞-基质间粘附分子相互作用并不仅限于细胞的粘附和附着,对参与粘附细胞的活化、分化、生长和分泌等也有显着的影响,并有赖于粘附分子将胞外粘附分子相互作用的信号向细胞内的传导。粘附分子所传导的信号可能作为一种辅助因素,协同其它刺激因素的作用,如α3β1、α4β1、α5β1、α6β1和αLβ2与配体的作用可以协同TCR/CD3介导的淋巴细胞增殖和细胞因子产生,提示淋巴细胞与胞外基质的作用可能影响其活化状态。此外单核细胞及中性粒细胞表面integrin分子与配体的作用也参与诱导细胞产生炎症因子的过程。
酪氨酸磷酸化是细胞内信号传导的一个重要途径,而integrin分子与某些细胞内的酪氨酸磷酸化发生有关。血小板活化过程伴随着广泛的细胞内蛋白酪氨酸磷酸化,integrin分子αⅡbβ3的表达是血小板内酪氨酸磷酸化过程发生的必要条件,αⅡbβ3不表达或其与配体的作用被阻断均可阻碍血小板内的酪氨酸磷酸化过程。但αⅡbβ3单独作用并不足以引起酪氨酸磷酸化,而只是作为其它刺激活化因素的必要辅助条件。对其它细胞进行的研究结果同样提示integrin分子参与细胞内酪氨酸磷酸化的过程,如使KB细胞(一种癌细胞系)表达的α3β1分子发生交联后可以发现细胞内一种分子量为115~130kDa的分子发生酪氨酸磷酸化;NIH3T3细胞粘附干纤粘蛋白分子或用抗integrin抗体刺激,可以导致细胞内一种蛋白发生酪氨磷酸化。
某些细胞(如成纤维细胞、内皮细胞)粘附于纤粘连蛋白后胞浆的pH值升高。胞浆中pH值升高是integin分子与配体作用后向细胞内传导信号的结果,与细胞的伸展和生长有关。
吞噬细胞表达的integrin分子与纤粘连蛋白或层粘连蛋白等配体作用后可以导致细胞吞噬作用的增强,近年来研究表明这一现象与integin分子结合配体后影响细胞膜磷脂酰肌醇代谢过程有关。
一种称之为白细胞应答整合素的integrin分子(leukocyte response integrin,LRI),与integrinβ3存在交叉反应,但不同于已知的任何一种integrin分子。LRI介导的吞噬增强作用可被蛋白激酶C抑制剂H7和Staruosporin所阻断,也可被百日咳毒素、钙离子螯合剂MAPTAM及结合磷脂酰肌醇的新霉素所抑制,因此推测LPI与配体的作用可能引起G-蛋白依赖的磷脂酶C的活化,导致细胞内PKC的活化和Ca[SB]2+[/SB]浓度升高。此外还发现一种与LPI共沉淀的被称作整合素相关蛋白(integrin associated protein IAP)的5kDa分子,可能属于一种多次跨膜细胞表面分子家族。抗IAP的抗体可以抑制LRI介导的吞噬增强作用,推测IAP可能与LRI结合配体的亲和力有关或参与LPI的信号传导过程。