第二节 免疫球蛋白基因的结构和多样性
<>- <><><>< =>< =>()< =>()<><><><><>κ<><><><><>λ<><><><><><><>.<> <>()、。、(-)。()。,,。。
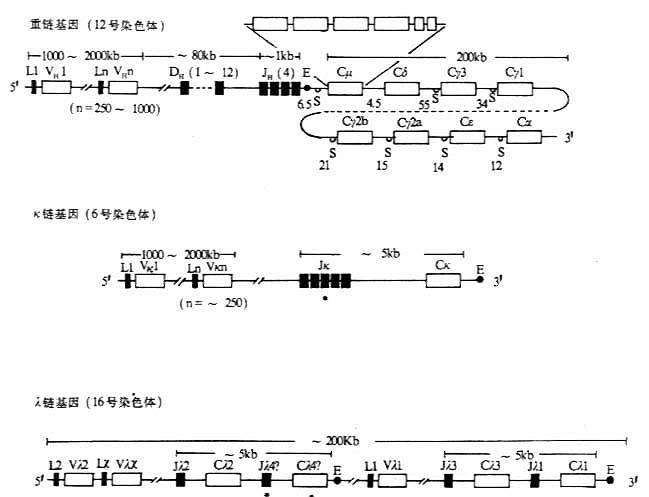
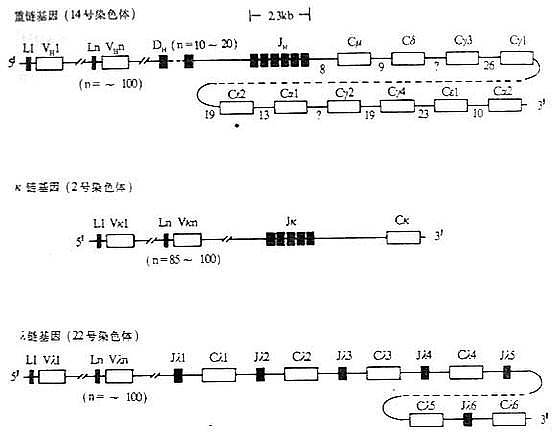
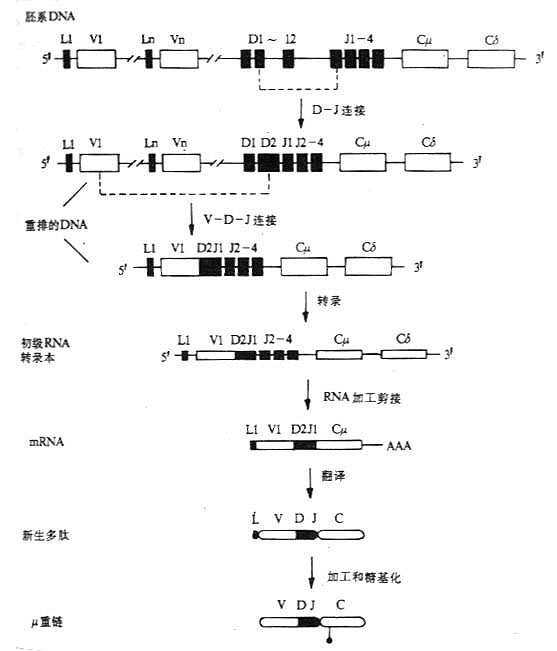
一、 Ig重链基因的结构和重排
<>、、。 <><>()() <>、、。 <>. ~,、、。 <>():[][/]~。[][/](&;%),().,,~。():;,( ,)。 <>():()。[][/]。。[][/],[][/][][/],[][/],~,[][/][][/],[][/][][/]'.。[][/]~。 <>():(),。[][/]~,[][/]。[][/],μ.。[][/][],[/][][/]。 <>、、,,,。 <>--。 <>. ,-。,-。[][/]'(),[][/][]μ[/]()。[][/]-(-),[][/],-。 <>( ),''。'、',:()( );()、/();()( ),±±。/(/),:(-)。 <>
 <>-
<>:(): : :<>: : :<>: *:<>()()。<>()[][/],,[]μ[/]。<>()λλλ。
<>
<>-
<>:(): : :<>: : :<>: *:<>()()。<>()[][/],,[]μ[/]。<>()λλλ。
<> <>-
<>:(): : :<>: : *:<>()()<>()[][/],
<>/()//()/(),、。。(- ),( ,-)(-),。:(),,。。(),(- ),,,,。( -)( ),/(/)。,( ,)。,。,,、,。
<>
<>-
<>:(): : :<>: : *:<>()()<>()[][/],
<>/()//()/(),、。。(- ),( ,-)(-),。:(),,。。(),(- ),,,,。( -)( ),/(/)。,( ,)。,。,,、,。
<>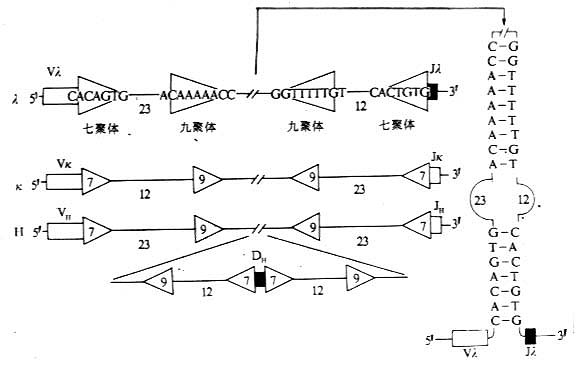 <>-
<><>()()
<>. ,,.。(),( ),α[][/]'。“ ”[][/]',δ“”。[][/],''μ-δ-γ-γ-γ-γ-ε-α。[][/]μ-δ-γ-γ-ε()α-γ-γ-ε-α。γ-γ-ε-αγ-γ-ε-α,[][/]。
<>. 。( )( )[][/],[][/]、[][/],,,。。
<>,α,。-,,;-,-。-γ,。-β、--(-)。:(),、,-、-。,。(),。-,ε(),。
<>- <>(%)
<><><><><><><><><><><>()<><><>&;<>&;<>&;<><>-<><><>&;<><>&;<><>-γ<><><><>&;<>&;<><>-β-<><><>&;<>&;<>
<>:()++,, ,。<>(),%。
<>。
<>()( ): 。[][/],μδ,[][/]γ,,γ;γ,ε。,,。。
<>():,( )。 μδ,,μδ,[][/]μδ,,( )μδ。( )μδ。δ,μ;μ,δ。,μδ,。 με(),、。
<>
<>-
<><>()()
<>. ,,.。(),( ),α[][/]'。“ ”[][/]',δ“”。[][/],''μ-δ-γ-γ-γ-γ-ε-α。[][/]μ-δ-γ-γ-ε()α-γ-γ-ε-α。γ-γ-ε-αγ-γ-ε-α,[][/]。
<>. 。( )( )[][/],[][/]、[][/],,,。。
<>,α,。-,,;-,-。-γ,。-β、--(-)。:(),、,-、-。,。(),。-,ε(),。
<>- <>(%)
<><><><><><><><><><><>()<><><>&;<>&;<>&;<><>-<><><>&;<><>&;<><>-γ<><><><>&;<>&;<><>-β-<><><>&;<>&;<>
<>:()++,, ,。<>(),%。
<>。
<>()( ): 。[][/],μδ,[][/]γ,,γ;γ,ε。,,。。
<>():,( )。 μδ,,μδ,[][/]μδ,,( )μδ。( )μδ。δ,μ;μ,δ。,μδ,。 με(),、。
<> <>-
<><>()
<>(),'。,,~,.,~,,μ,ε。:(),,[][/],;(),α,;(),~,。
<>
<>-
<><>()
<>(),'。,,~,.,~,,μ,ε。:(),,[][/],;(),α,;(),~,。
<>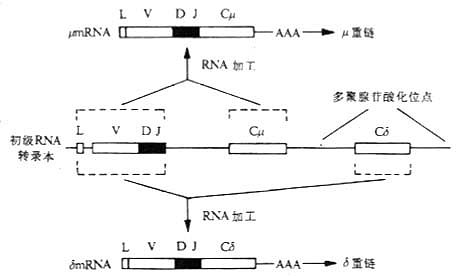 <>-
<>μ、αδ,( ),,,。μ、、、[]μ[/]、[]μ[/]、[]μ[/]、[]μ[/][]μ[/]'。
<>、、、,。
<>()( ,):、、……。
<>():( )。δ,,~,μ、γ、αε,。,,。μ[()],~,,。,γ。α,ε。,μ/γμ/γ,,,。
<>():,,Ⅱ。,,( - ),。,().
<>
<>-
<>μ、αδ,( ),,,。μ、、、[]μ[/]、[]μ[/]、[]μ[/]、[]μ[/][]μ[/]'。
<>、、、,。
<>()( ,):、、……。
<>():( )。δ,,~,μ、γ、αε,。,,。μ[()],~,,。,γ。α,ε。,μ/γμ/γ,,,。
<>():,,Ⅱ。,,( - ),。,().
<>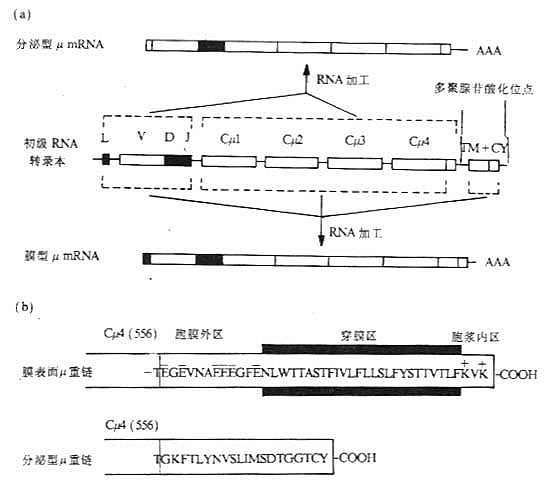 <>- μμ
<>:(),μμ。<>()()μ。μ,,;μ,。
<>()():κ,。,[][/]'。κ,,()。,(- ),。,。
<>,,( ),'(),,。
<>
<>- μμ
<>:(),μμ。<>()()μ。μ,,;μ,。
<>()():κ,。,[][/]'。κ,,()。,(- ),。,。
<>,,( ),'(),,。
<> <>- μ、
<><>()、。
<>μ、μ,-。
<>- μ、
<><>()、。
<>μ、μ,-。
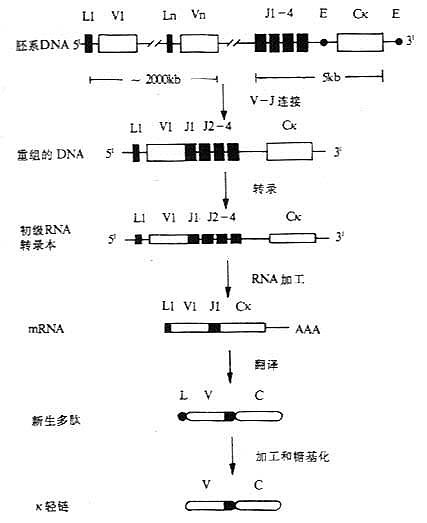
二、Ig轻链基因的结构和重排
<>,,。κ,κ,λ。 <><>()κ <>,κ,~;κ,:κ。,κ~,~,、。,κ。,κ,。κ,~。κκ′,κ。κ,(~),κ。κκ.。κκ。κκ×κ=。 <><>()λ <>λ-。,[]λ[/][]λ[/],():[]λ[/][]λ[/][]λ[/][]λ[/](-)[]λ[/][]λ[/][]λ[/][]λ[/](-),。 <>- λ <><><><><><><><><><> < =><><> <><>′<>-~-<><>< =><><>′<>-~-<><><><>′<>~<><><> <><>′<>~<><><> <><>′<>~<><>< =><><><> <>()<><><><> <>() <>λ[]λ[/]、[]λ[/][]λ[/][]λ[/],[]λ[/]“-”([]λ[/][]λ[/][]λ[/][]λ[/])′;[]λ[/]“-”([]λ[/][]λ[/][]λ[/][]λ[/]);[]λ[/][]λ[/]′;[]λ[/][]λ[/]、[]λ[/],[]λ[/][]λ[/],[]λ[/][]λ[/][]λ[/][]λ[/][]λ[/][]λ[/],[]λ[/][]λ[/][]λ[/][]λ[/][]λ[/],[]λ[/][]λ[/][]λ[/],[]λ[/][]λ[/][]λ[/][]λ[/][]λ[/][]λ[/]。[]λ[/]、[]λ[/]。[]λ[/][]λ[/]。[]λ[/][]λ[/]。 <>,λ,[]λ[/],[]λ[/]~,[]λ[/][]λ[/]。λ[]λ[/][]λ[/][]λ[/]/[]λ[/],[]λ[/],、,λ。 <>
 <>- κ、
<>- κ、
三、免疫球蛋白基因表达的调节
<><>() <>(- )(,)(,)。(- )。(- ,),,。。 <>. ,κ、。。,、()。( ),;,。 <>.-κ κ ,-κ( )。 <>()-κ:-κ、、-,Ⅰ,-α,β,-、-、-、-α、-β、、-、。κ(- )-κ,-κ,κ。 <>()-κ:-κ,-κ[]-[/]~[]-[/],。κ,-κ。κ(),-κ/κ,-κ,,。。。-κκ,-κκκ,。 <>
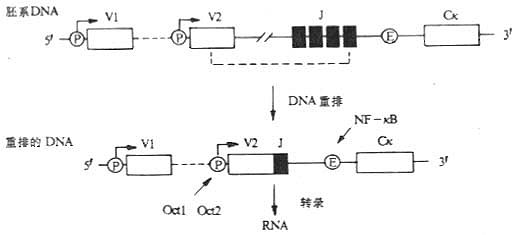 <>-
<>:()κκ,,-κ,、。
<><>()
<>( )。,,。,。()。,,κ,κ,λ,( )。
<>-
<>:()κκ,,-κ,、。
<><>()
<>( )。,,。,。()。,,κ,κ,λ,( )。
四、免疫球蛋白的多样性
<>,[][/],。。 <>.、、 ( )() 、。。[][/]、[][/][][/]、,.×[][/];κκ,κ-.×[][/]。κ(.×[][/])×(.×[][/])=.×[][/]。 <>- 、κ <><><>< =><><><><> <><> <><><> <><> <> <>--<>.×[][/]<> <><> <> <> <> <>.×[][/]<><>κ<><>-<>.×[][/]<> <>:、。 <>. ,[][/]---。[][/]′[][/]′,、,(-)。 <>.( ) 。,~×[]-[/],。。 <>.( ) ,(- )[][/]-[][/][][/]-[][/]。。,[][/]-[][/][][/]-[][/],( ,)。,( ),,,。 <>
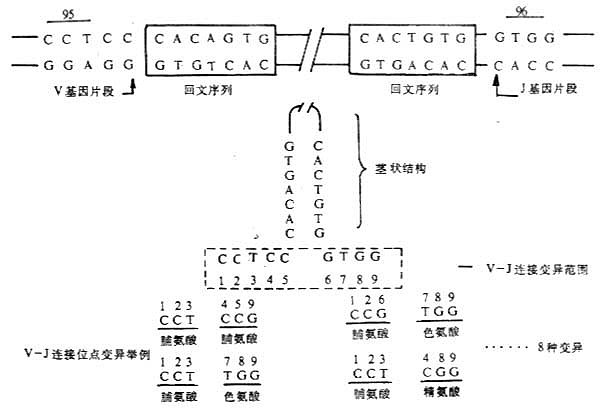 <>- -
<>
<>- -
<>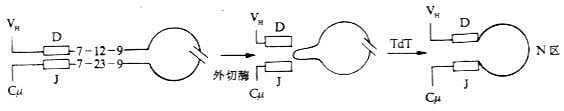 <>- -()
<>. -,κ.×[][/],λ。
<>- -()
<>. -,κ.×[][/],λ。
上一篇:第一节 免疫球蛋白超家族的组成和特点
下一篇:第三节 T细胞受体基因