第二节 细胞因子的结构和生物学特征
由于基因工程技术的迅速发展,许多细胞因子的cDNA克隆获得成功,并获得了高活性基因表达产物,这给细胞因子的细胞生物学和分子生物学的研究提供了必要的前提。目前已有IL-2、EPO、G-CSF、GM-CSF、IFN-γ和IFN-α等细胞因子投放市场,有更多的细胞因子正在进行不同期的临床验证。细胞因子在正式投入市场成为商品前,必须经过临床前筛选实验、临床Ⅰ期、Ⅱ期、Ⅲ期试用等几个阶段的验证。
一、白细胞介素(IL)
在1979年第二届国际淋巴因子专题讨论会上,将来自单核-巨噬细胞、T淋巴细胞所分泌的某些非特异性发挥免疫调节和在炎症反应中起作用的因子称为白细胞介素(interleukin,IL)。目前已知许多IL是来自单核-巨噬细胞和淋巴细胞以外的其它细胞。已正式命名的白细胞介素有IL-1~IL-15。
(一)IL-1
IL-1是一种单核因子。1972年Gery等发现人白细胞培养的上清中含有一种可溶性物质,这种物质可促进小鼠胸腺细胞对植物血凝素(PHA)的有丝分裂反应。起初命名为淋巴细胞激活因子(lymphocyte-activatingfactor,LAF)或内源性热原质(endogenous pyrogen)、破骨细胞激活因子(osteoclast activating factor)、黑素瘤细胞生长抑制因子(melanomagrowth inhibitory factor)等,1979年国际统一命名为IL-1。
1.IL-1的产生 IL-1可由多种细胞合成和分泌。
(1)单核细胞、巨噬细胞(如腹腔粘连细胞peritoneal cell,PC)、树突状细胞等在摄取抗原抗体复合物后或在抗原提呈过程中可产生IL-1。在大多数刺激剂刺激外周血单个核细胞(PBMC)条件下,IL-1βmRNA水平要高于IL-1αmRNa 20~25倍。
(2)小鼠巨噬细胞细胞系P388D1、J774、PU5-1.8、WEHI-3以及人前单核细胞株U937等在脂多糖(LPS)刺激后都能分泌大量的IL-1。
(3)表皮细胞、NK细胞、B细胞、成纤维细胞、内皮细胞、脑胶质星状细胞、肾小球系膜细胞(mesangial cell)、滑膜衬里细胞(synovial lining cell)、平滑肌细胞、上皮细胞、胎盘细胞、白血病细胞、PMN等在某些条件下亦可产生IL-1。
许多因素可以直接影响单核-巨噬细胞IL-1的分泌:①细胞因子如巨噬细胞激活因子(MAF)、集落刺激因子(CSF)、IFN-α、IFN-γ对IL-1产生具有增强作用。②LPS、PPD、BCG和李斯特菌,葡萄球菌、链球菌外毒素,活病毒等也是IL-1产生的刺激剂。在外周血中20pg/ml内毒素刺激单核细胞即可产生IL-1,因此在一般培养条件下,由于微量内毒素的污染可刺激单核细胞分泌IL-1。10ng/mlLPS可使单核细胞合成IL-1增加100倍。③蛋白激酶C(PKC)的激活剂乙酸肉豆蔻佛波醇(phorbol myristateacetate,PMA)以及钙离子载体(calcium ionophore)如A23187均具有强烈的刺激作用。④皮质类固醇和前列腺素则对IL-1的产生有抑制作用。
2.IL-1的分子结构和基因 完整的人IL-1α和IL-1β基因组分别为10.5kb和7.8kb。人和小鼠IL-1基因定位于2号染色体,均含7个外显子。IL-1前体(ProIL-1)为31kDa,通过蛋白水解酶裂解形成成熟的IL-1分子。IL-1在不同种属中有较高同源性。在氨基酸水平上,IL-1α和IL-1β在不同种属同源性分别为60%~70%和75%~78%;但在同一种属中IL-1α与IL-1β同源性只有25%。人IL-1α(PI5.0)和IL-1β(P17.0)分别由159和153个氨基酸残基组成,分子量约17.5kDa,同源性为28%。IL-1对糜蛋白酶敏感。不同细胞所产生IL-1的等电点可有所差异。
3.IL-1的受体 T细胞、成纤维细胞表面IL-1受体为80kDa,而B细胞则为68kDa。编码这两种IL-1受体是不同基因产物。P80IL-1R称为IL-1RtI(CDw121a),P68IL-IR称为IL-1RtⅡ(CDw121b)。
表4-1 IL-1 Rt Ⅰ和IL-1RtⅡ的比较
| IL-1 RtⅠ | IL-1RtⅡ | |
| 结构 | ||
| 同源性 | Ig超家族(3个C2区) | Ig超家族(3个C2区) |
| 分子量(kDa) | 80 | 68 |
| 氨基酸数目 | 549 | 384 |
| 胞膜外 | 319 | 329 |
| 穿膜 | 20 | 26 |
| 胞浆内 | 213 | 29 |
| 主要分布细胞 | 广泛,T细胞、成纤维细胞等 | EBV转化B细胞、Raji、PMN、骨髓细胞等 |
| 与配体结合 | ||
| 结合能力 | IL-1α>IL-1β | IL-1β>IL-1α |
| 丝氨酸/苏氨酸 | +(信号转导) | (功能尚不清) |
| 残基磷酸化 | ||
| 配体受体结合后变化 | 易内化 | 易降解 |
(1)IL-1RtⅠ:IL-1RtⅠ cDNA克隆在人和鼠均已获得成功。IL-1RtⅠ为穿膜蛋白,胞膜外区有3个结构域属免疫球蛋白超家族,穿膜区有20个氨基酸残基,胞浆区含有丝氨酸和苏氨酸残基,当IL-1与IL-1RtⅠ结合后丝氨酸和苏氨酸很快被磷酸化。通过基因转染Hela细胞实验证明,IL-1RtⅠN端2个结构域与配体结合有关。针对N端17个氨基酸片段的McAb能阻断IL-1RtⅠ与IL-1结合。IL-1与IL-RtⅠ结合后即发生内化(internalization)。成纤维细胞、平滑肌细胞主要表达IL-1RtⅠ。一般来说,IL-1RtⅠ可与IL-1α和IL-1β相结合,但IL-1α与Ⅰ型受体结合能力较高,而IL-1β与Ⅱ型受体结合较高。IL-1与不同种属不同细胞结合后的生物学效应有所差别,如人和鼠IL-1α结合到人内皮细胞上的亲和力相同,但产生的生物学效应不完全相同。抗IL-1RtⅠMcAb在体内和体外均可抑制IL-1在生物学效应。
(2)IL-1RtⅡ:主要分布于EBV转化的B细胞、Raji细胞、巨噬细胞、胎盘、Th2克隆、活化T细胞、PMN和骨髓细胞等。胞膜外区有3个结构域属免疫球蛋白超家族,与IL-1RtⅠ之间有28%氨基酸同源性,穿膜区有更高的同源性,但胞浆区要比Ⅰ型受体短,可能在介导信号传递上有差别。IL-1与IL-1RtⅡ结合后易发生降解而不象IL-1RtⅠ那样发生内化。IL-1RtⅡ经蛋白水解酶水解后可形成可溶性的IL-1结合蛋白(soluble IL-1 binding protein,sIL-1BP),46kDa,与IL-1β有较高亲和力,在自然情况下sIL-1BP是IL-1β的抑制剂。可溶性IL-1R(solubleIL-1 receptor,sIL-1R)可有效防止小鼠心脏移植排斥反应,减轻Lewis大鼠的实验性关节炎和过敏性大脑炎。
在T细胞中,CD4阳性细胞亚群IL-1受体表达要高于CD8阳性T细胞亚群。以小鼠胸腺瘤细胞系EL-4为模型,发现IL-1α和IL-1β可结合到相同的高亲和力受体。现已发现联合免疫缺陷病人的T细胞表达IL-1R缺陷,对抗原刺激不发生增殖反应,也不产生IL-2,病人易患机会致病菌感染。
4.IL-1受体拮抗物 在某些白血病患者血清和尿中以及单核细胞培养上清中发现一种多肽性质的IL-1特异性抑制因子,称为IL-1受体拮抗物(interleukin 1 receptorantagonist,IL-1ra),又称IL-1受体拮抗蛋白(IL-1 receptor antagonist protein, IRAP)。
(1)IL-1ra的产生:IL-1ra体外可由LPS刺激的单核细胞,PMA、PHA、CSF刺激的单核细胞系产生。
(2)IL-1ra分子的结构和基因:IL-ra基因克隆1990年获得成功,编码人IL-1α、IL-1β和IL-1ra基因都定位于2号染色体。IL-1racDNA编码的多肽为17kDa,糖基化后分子量为25kDa,但糖基对IL-1ra活性并非必需。未成熟的IL-1ra分子为177个氨基酸残基的肽链,N端25个氨基酸多为疏水性氨基酸,构成典型的信号肽顺序。成熟分子由152个氨基酸残基组成。在65、68、116及122位上有4个保守的半胱氨酸残基,Cys65-116,Cys68-122间形成链内二硫键。从cDNA推算的氨基酸序列IL-1ra与IL-1α和IL-1β分别有19%和26%的同源性,人和小鼠的IL-1ra有77%同源性。
(3)IL-1ra的生物学作用:IL-1ra能特异性地抑制T细胞表面IL-1R与IL-1结合,但不抑制TNF或IL-2与相应受体的结合。IL-1ra不与IL-1直接结合,而是一种IL-1与IL-1R相互结合的竞争性抑制物。rIL-1ra与Ⅰ型和Ⅱ型IL-1R都能结合,但与IL-1RtⅠ结合的亲和力要高于与IL-1RtⅡ结合的亲和力。rIL-1ra、rIL-1α、rIL-1β与IL-1RtⅠ结合的亲和力比较相近,但rIL-1ra、rIL-1α与IL-1RtⅡ结合的亲和力要低于rIL-1β与IL-1RtⅡ结合的亲和力。IL-1ra能抑制IL-1刺激滑膜细胞PGE2的产生和软骨细胞胶原酶合成,抑制胸腺细胞的增殖以及中性粒细胞、嗜酸性粒细胞与内皮细胞的粘附。在体内可抑制IL-1引起的发热。IL-1ra可结合T细胞和成纤维细胞表面IL-1RtⅠ,也能抑制IL-1与PMN、B细胞、髓样单核细胞白血病细胞IL-1RtⅡ的结合。IL-1ra可抑制PBMC、骨髓细胞衍生的髓样淋巴细胞白血病细胞自发增殖和自发产生IL-1、IL-6和GM-CSF。在体内,IL-1ra可阻止LPS引起的家兔死亡,减轻免疫复合物所诱导的炎症,抑制小鼠骨髓移植后GVHR的发生,提高存活率,此外,还可防治动物实验性溃疡性结肠炎。
(4)IL-1ra与临床:正常人血清IL-1ra水平在200pg/ml以下,感染、炎症以及内毒素血症病人血清中IL-1ra水平可升高到8ng/ml。应用IL-1ra治疗败血症已进入Ⅲ期临床验证,死亡率明显下降。此外IL-1ra治疗类风湿性关节炎也已开始在临床验证。IL-1ra在体内的副作用很小,但应用剂量较大,阻断IL-1 50%生物学效应时所用IL-1ra的用量是IL-1用量的10~500倍。
5.IL-1的生物学作用 IL-1具有广泛的免疫调节作用,并有致热和介导炎症的作用,它的生物学功能是通过与相应高亲和力受体结合而介导的,IL-1生理条件下的浓度仅在10[SB]-12[/SB]~10[SB]-14[/SB]M之间。IL-1作用无明显的种属特异性,人IL-1可作用于小鼠源性的细胞。主要表达IL-1RtⅡ的细胞似乎比表达IL-1RtⅠ细胞相对有种属特异性。
(1)促进胸腺细胞、T细胞的活化、增殖和分化:T细胞经抗原、有丝分裂原或抗TCR/CD3刺激后表达IL-1受体,在IL-1作用下T细胞被活化,由G[XB]0[/XB]期进入G[XB]1[/XB]期。活化后的T细胞分泌IL-2、IFN-γ、GM-CSF、IL-4等细胞因子,并表达IL-2受体进而T发生增殖和分化。IL-1还可增加T细胞表面MHCⅡ类抗原的表达。IL-1能诱导杀伤性T淋巴细胞(CTL)的分化,在混合淋巴细胞培养(MLC)中,IL-1诱导CTL的产生可能是通过促进T细胞分泌IL-2和IFN-γ。IL-6可协同IL-1活化T细胞和刺激IL-2的产生。
(2)促进B细胞功能:协同IL-4等细胞因子刺激B细胞的增殖和分化,促进免疫球蛋白的合成和分泌,这种作用可能是通过IL-1诱导PBMC产生IL-6而介导的。
(3)刺激骨髓多能干细胞的增殖:现已证实IL-1与Stanley(1986)报道的血细胞生成素-1(hemopoietin-1)是同一种分子。IL-1刺激造血细胞和成纤维细胞产生CSF,增加造血细胞CSF受体的数量,并协同IL-3、IL-6、G-CSF、M-CSF、GM-CSF、SCF等因子刺激造血功能,对粒单系祖细胞和巨核系祖细胞均有刺激作用。此外,IL-1可刺激干细胞产生SCF,IL-1本身可作用早期干细胞,激活干细胞从Go期进入增殖周期。IL-1能预防化疗造成的骨髓抑制已进入临床Ⅱ期验证。
(4)增强NK细胞的杀伤活性:通过提高NK细胞对IL-2等细胞因子的敏感性增强其杀伤活性,IL-1与IL-2或IFN有协同刺激NK细胞活性的作用。
(5)促进多种免疫分子的基因表达:如IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、TNF-α、TNF-β、INF-β、G-CSF、GM-CSF、GM-CSF,IL-2Rα链(Tac),补体C2、Bf,粘附分子以及c-fos、c-myc和c-jun等原癌基因的表达。C-fos和C-jun组成活化蛋白-1(AP-1),活化IL-2基因的启动子,诱导B细胞κ链核因子(NF-κB)活化免疫球蛋白κ链基因,诱导NF-IL-6转录因子活化IL-6启动子。
(6)刺激单核细胞和巨噬细胞产生IL-6和TNF,并通过单核细胞和巨噬细胞产生IL-8介导对中性粒细胞的趋化作用。此外,IL-1诱导内皮细胞活化,刺激中性粒细胞释放炎症蛋白和炎症介质,直接参与炎症发生过程。
IL-1与TNF生物学性质,尤其在非免疫性作用方面较为相似(见表4-8)。抗TNF-α中和抗体可预防内毒素引起的休克,同时降低了IL-1和IL-6水平,表明在某些条件下,IL-1水平受到TNF的调控。
6.IL-1与临床
(1)发热:IL-1是一种内源性热原质(endogenous pyrogen), IL-1引起发热作用与内毒素不同,IL-1对热敏感,反复注射不产生耐受。IL-1引起发热的机理之一可能是IL-1促进单核-巨噬细胞释放PGE2,刺激下丘脑体温调节中枢,引起发热。阿斯匹林、消炎痛等抑制PGE2的合成,可作为解热剂。PGE2对IL-1产生有负反馈作用。老龄人或癌症患者PBMC中单核细胞产生IL-1能力低于正常人,可能与感染后不易出现明显发热等临床症状有关。
(2)促进肝细胞合成急性期蛋白(acute phase protein):如C-反应蛋白、血清淀粉样A蛋白(serum amyloid a protein,SAA)和α酸性糖蛋白(α-acid glycoprotein,αAGP)以及某些补体的组分,有利于机体抵抗病原微生物等,是机体非特异性防御因素之一。低剂量IL-1可提高动物对脑型和恶性疟疾的抵抗力。
(3)对间质细胞和其它细胞的作用:类风湿关节炎关节囊内巨噬细胞受到刺激和活化后可分泌IL-1,刺激滑膜细胞、软骨细胞、成纤维细胞分泌大量PGE2、胶原酶和中性蛋白酶等,从而使关节中的胶原组织降解,骨质吸收,局部血管通透性增加,直接参与关节的病理损伤。多种关节炎的关节液中可测出高水平IL-1。IL-1还可刺激脑组织神经胶质细胞增生,形成瘢痕,与癫痫发作可能有关。此外,IL-1刺激肾小球系膜细胞增生,导致肾实质纤维化和慢性肾功衷竭。
(4)抗肿瘤作用:由于IL-1能协同IL-2、IFN-γ诱导CTL和NK细胞的杀伤活性,促进杀伤细胞IL-2受体的表达以及成纤维细胞分泌IL-6,因此具有抗肿瘤作用。临床已试用IL-1治疗肿瘤。
(5)抗放射作用(radioprotective):小鼠注射IL-1100ng在950R照射条件下可提高白细胞水平,延长存活时间,能预防放疗造成的骨髓抑制。临床上已试用IL-1治疗骨髓移植。最近在动物实验中发现IL-1能降低血糖水平,有可能成为治疗糖尿病的新药。
(二)IL-2
1976年Morgan等发现小鼠脾细胞培养上清中含有一种刺激胸腺细胞生长的因子,由于这种因子能促进和维持T细胞长期培养,称为T细胞生长因子(tcell growth factor,TCGF),1979年统一命名为白细胞介素2(interleukin 2,IL-2)。
1.IL-2的产生 IL-2主要由T细胞或T细胞系产生。
(1)CD4阳性或CD8阳性T细胞:有丝分裂原刺激CD4阳性或CD8阳性T细胞亚群均可产生IL-2;同种异体抗原主要刺激CD4阳性T细胞分泌IL-2。PBMC、脾脏、淋巴结和扁桃腺中的T细胞受到刺激后都能产生IL-2。在小鼠Th细胞中,只有Th1亚群可产生IL-2。
(2)T细胞肿瘤细胞系或白血病细胞系:人和动物某些T细胞白血病细胞系或肿瘤细胞在有丝分裂原、钙离子载体(如A23187)或PMA刺激下可产生高水平的IL-2。如长臂猿T细胞系MLA144可自发产生IL-2,小鼠胸腺瘤细胞系EL-4和人Jurkat细胞静止状态不合成和分泌IL-2,刺激后可分泌高水平的IL-2。
(3)T淋巴细胞杂交瘤:T淋巴细胞杂交瘤123,FS6-14.13,HT-24A等在ConA刺激下产生IL-2。
(4)应用基因工程技术制备:1983年Taniguchi等从ConA刺激的Jurkat白血病T细胞中克隆成功IL-2cDNA,并在大肠杆菌中得到高水平的表达。目前应用基因工程技术所制备和纯化的IL-2已用于临床治疗某些肿瘤和其它疾病。
2.IL-2的分子结构和基因 人IL-2含有133氨基酸残基,分子量为15.5kDa。天然IL-2在N端含有糖基,但糖基对IL-2的生物学活性无明显影响,等电点在6.6~8.2。IL-2分子含有3个半胱氨酸,分别位于第58、105和125位氨基酸,其中58位与105位半胱氨酸之间所形成的链内二硫键对于保持IL-2生物学活性起重要作用。在IL-2基因产物的提纯和复性过程中,如二硫键配错或分子间形成二硫键都会降低IL-2的活性。现已有应用点突变,将第125号位半胱氨酸突变为亮氨酸或丝氨基,使只能形成一种二硫键,保证了在IL-2复性过程的活性。还有报道用蛋白工程技术生产新型rIL-2,将IL-2分子第125位半胱氨酸改为丙氨酸,改构后IL-2比活性比天然IL-2明显增加。人IL-2基因定位于第4号染色体,长约5kb,由4个外显子和3个内含子组成。人和小鼠IL-2基因DNA序列有63%同源性。
3.IL-2的受体 IL-2R是由α、β和γ三条链组成。
(1)IL-2Rα链:Uchiyama(1981)首次制备了抗活化T细胞抗原Tac的McAb,与IL-2相互竞争结合到Tac阳性细胞。Tac的分子量为55kDa。1984年Leonard将Tac分子的cDNA克隆成功。Tac分子为糖蛋白,由272个氨基残基组成,包括21个氨基酸残基信号肽,成熟分子含251个氨基酸,含有多个半胱氨酸,2个N-糖基化位点,穿膜区和胞浆区分别含19和13个氨基酸残基。人Tac的基因定位于第10号染色体,包括8个外显子和7个内含子,长约25kb。Tac(p55)即为IL-2受体α链(或亚单位),又称CD25,是活化T淋巴细胞的标志。在骨髓移植中如除去Tac阳性供体细胞可以降低移植物抗宿主反应(GVHR),现已进入Ⅱ期临床验证。也可用抗IL-2r McAb选择性地封闭、消除活化的效应细胞,从而治疗同种异体移植物排斥反应及某些自身免疫性疾病。
(2)IL-2Rβ链:分子量70kDa,故又称p70,在人白细胞分化抗原中编号为CD122。人IL-2Rβ链基因定位于22号染色体。成熟IL-2Rβ链有525个氨基酸,5个N糖基化位点,包括胞膜外区、穿膜区和胞浆区。胞膜外区由214个氨基酸组成,有8个Cys,其结构上有1个红细胞生成素(EPO)受体超家族特征性的结构域,还有1个Ⅲ型纤维粘连蛋白结构域。跨膜区25个氨基酸。胞浆区有286个氨基酸,与EPO受体胞浆区有一定的同源性。IL-2Rβ链本身无酪氨酸激酶区,但胞浆区中有两个结构域:一个是靠近膜端的丝氨酸富含区,在IL-2诱导的增殖信号传递中起重要作用;另一个是与酪氨酸激酶相联的酸性区域。缺乏酸性区域的IL-2Rβ链突变体能传导增殖信号,并诱导转录c-myc,不能介导诱导转录因子Fos的作用;缺乏丝氨酸富含区的IL-2Rβ链突变体不能诱导细胞增殖及c-myc的转录。因此,酪氨酸激酶途径似乎与c-fos 基因的诱导有关,而非激酶依赖的途径与c-myc基因的诱导有关。IL-2Rβ链主要分布于T细胞、大颗粒淋巴细胞(LGL)、B细胞、pre-T细胞。
(3)IL-2Rγ:糖蛋白,含347个氨基酸,分子量64kDa。胞膜结构特征属于红细胞生成素家族成员,胞浆区含86个氨基酸,从288~321位氨基酸序列似乎同源于src同源区2(SH2),此区能与一些磷酸化蛋白中磷酸化酪氨酸残基相连,参与信号的转导。IL-2Rγ链表达于多种淋巴样细胞表面,如Molt-β、Molt-4、Jurkat、MT-1、MT-2以及EB病毒感染的Raji细胞。
(4)IL-2R的组成与亲和力的关系:单独IL-2Rγ链不能结合IL-2,但对于中亲和力IL-2R(βγ链)、高亲和力IL-2R(αβγ链)的组成、IL-2的内化以及信号转导是必需的。X-性联重症联合免疫缺陷症病人的IL-2Rγ基因发生突变而丧失IL-2R功能。
表4-2 三种亲和力IL-2R的组成
| 组成 | 亲和力(Kd) | 细胞分布举例 |
| α链(p55,CD25) | 低,10[SB]-8[/SB]M | B淋巴细胞 |
| β链(p70,CD122)+γ链 | 中,10[SB]-9[/SB]M | YT(NK细胞株),MLA144 |
| α链+β链+γ链 | 高,10[SB]-11[/SB]M | PHA刺激母细胞,HUT102B2 |
(5)可溶性IL-2R:可溶性IL-2R(solubleIL-2 receptor,sIL-2R)是膜结合形式IL-2Rα链的脱落物,分子量45kDa。在人类T细胞白血病Ⅰ型病毒(HTLV-I)感染的HUT102B2细胞培养上清中含有大量sIL-2R。PBMC经丝裂原、CD3McAb和同种异体抗原刺激后可释放sIL-2R。正常人血清和尿液中亦可检出少量sIL-2R。sIL-2R可能与膜表面IL-2R(mIL-2R)竞争结合IL-2,从而成为一种免疫抑制物质。sIL-2R增高可见于某些恶性肿瘤、自身免疫病、病毒感染性疾病以及移植排斥等(见本章第三节)。
4.IL-2的生物学作用 IL-2的作用具有沿种系谱向上有约束性,向下无约束性的特点,如人的IL-2能促进小鼠T细胞的增殖,而小鼠的IL-2不能维持人T细胞的生长。IL-2体内的半衰期只有6.9分钟。有报道用PEG对IL-2加以修饰,对生物学活性无影响,半衰期可延长7倍左右。目前关于IL-2的生物学作用大都是体外实验的结果。具有中和活性的抗IL-2抗体可抑制IL-2的生物学活性。
(1)Th、Tc和Ts细胞都是IL-2 的反应细胞:IL-2对静止T细胞作用较弱。胸腺细胞和T细胞经抗原、有丝分裂原或同种异体抗原刺激活化后有在IL-2存在的条件下进入S期,维持细胞的增殖。IL-2可刺激T细胞转铁蛋白受体(TfR,CD71)、胰岛素受体、MHCⅡ类抗原的表达,并产生多种淋巴因子如IFN-γ、IL-4、IL-5、IL-6、TNF-β及CSF等。
(2)诱导CTL、NK和LAK等多种杀伤细胞的分化和效应功能,并诱导杀伤细胞产生IFN-γ、TNF-α等细胞因子。IL-2可增强CTL细胞穿孔素(perforin)基因的表达。
(3)直接作用于B细胞,促进其增殖、分化和Ig分泌。已发现活化的B细胞也可具有IL-2R,IL-2对B细胞的调节作用除通过刺激T细胞分泌B细胞增殖和分化因子外,还可能有直接的调节作用。
(4)活化巨噬细胞。
5.IL-2的临床应用 目前重组IL-2已用于临床治疗肿瘤以及感染性疾病等。
(1)抗肿瘤:IL-2在体外可诱导PBMC或肿瘤浸润淋巴细胞(TIL)成为淋巴因子激活的杀伤细胞(LAK)。LAK/IL-2对肾细胞癌、黑素瘤、非何杰金氏淋巴瘤、结肠直肠癌有较明显疗效,对肝癌、卵巢癌、头颈部鳞癌、膀胱癌、肺癌等有不同程度的疗效。近年来已开始采用IL-2基因治疗对黑素瘤、肾细胞癌以及神经母细胞瘤等肿瘤等进行临床验证。
(2)治疗感染性疾病:动物实验结果表明,IL-2对某些因细胞免疫功能低下而受病毒感染,需增强细胞免疫功能的病人有一定疗效。IL-2本身无直接抗病毒活性,它是通过增强CTL、NK活性以及诱导IFN-γ产生而介导抗病毒感染的。目前用IL-2治疗活动性肝炎已显示出可喜的苗头,对于单纯疱疹病毒感染、AIDS病(已进入Ⅱ期临床验证)、结节性麻风、结核杆菌感染等也有一定疗效。如rIL-2明显延长结核杆菌H37RV株感染小鼠和豚鼠的半数死亡时间,降低死亡率,减少感染动物脾、肺组织内的结核杆菌数。
(3)免疫佐剂作用(adjuvanticity):应用IL-2作为佐剂与免疫原性弱的亚单位疫苗联合应用,可提高机体保护性免疫应答的水平。此外,最近发现IL-2具有降低血压作用,IL-2治疗高血压已进入Ⅰ期临床验证。
(4)采用IL-2白喉毒素融合蛋白治疗类风湿性关节炎进入Ⅰ/Ⅱ期临床验证,约有74%患者病情得到改善,IL-2融合毒素主要作用于CD4阳性淋巴细胞,有较好的选择性。
rIL-2体内大剂量使用毒性作用较大,可引起毛细血管渗漏综合征(capillary leak syndrome,CLS)。此外,IL-2半衰期短,有时还可在体内诱导产生一定抗体。
美国Immunex应用抗IL-2Rα链McAb预防骨髓移植后GVHR进入Ⅱ期临床试验。
(三)IL-3
见本节集落刺激因子。
(四)IL-4
1982年Howard发现T细胞培养上清中有一种促进B细胞增殖的因子,起初命名为B细胞生长因子-1(b cell growth factor-1,BCGF-1)。有的实验室称为B细胞刺激因子-1(b cell stimulatingfactor-1,BSF-1)、T细胞生长因子-2(T cell growth factor-2,TCGF-2)。1986年基因克隆成功,国际统一命名为白细胞介素4(interleukin 4,IL-4)。
1.IL-4的产生 在人类IL-4主要由活化T细胞产生。在小鼠由Th2亚群产生。此外,肥大细胞、IL-2刺激小鼠T细胞系2.19、ConA刺激人Th克隆2F1、小鼠胸腺瘤EL-4细胞以及B细胞系CH12均能分泌IL-4。
2.IL-4的分子结构和基因 小鼠IL-4基因长约6kb,成熟IL-4分子由120氨基酸残基组成,裸肽分子量为14kDa,有3个糖基化点,经糖基化后IL-4分子量为30kDa。人IL-4基因定位于第5号染色体,由4个外显子和3个内含子组成,约10kb,是现知淋巴因子基因中较大的一个。成熟人IL-4分子由129氨基酸残基组成,15kDa,有2个糖基化点,含有6个半胱氨酸,参与分子内二硫键的组成。人与鼠IL-4DNA水平上有70%同源性,IL-4前体蛋白从N端到91位氨基酸以及C端到128位氨基酸人小鼠之间在氨基酸水平上有70%同源性,前体蛋白91至128位氨基酸之间很少有同源性,这可能与IL-4种属作用特异性有关,如人、鼠IL-4生物学作用上没有交叉反应。
3.IL-4的受体人 IL-4受体(IL-4R)由800氨基酸残基组成,分子量为140kDa,胞膜外区207氨基酸,跨膜区24氨基酸,胞浆区569氨基酸,与小鼠IL-4R有53%同源性,属于红细胞生成素受体超家族成员,最近命名为CDw124。在小鼠,T细胞、B细胞、胸腺细胞、骨髓细胞、巨噬细胞和肥大细胞表面都有IL-4R,每个细胞受体数目在100~2000左右,其亲和力Kd在10[SB]-10[/SB]~10[SB]-11[/SB]M,1~5×10[SB]-12[/SB]M浓度的IL-4可使B细胞增殖([SB]3[/SB]H-TdR掺入率)达到最大值的50%。LPS对B细胞IL-4R表达有正调节作用,受体数量可增加5~10倍。IL-4与相应受体结合后细胞内传递信号的途径尚不清楚,IL-4R胞浆区富含苏氨酸和丝氨酸,PTK和PKC可能参与受体介导的信号传递,IP3和Ca[SB]2+[/SB]浓度升高。在小鼠发现有不同剪接形式mRNA所翻译的分泌型(可溶性)IL-4R(sIL-4R)。sIL-4R与膜型IL-4R(mIL-4R)同配体IL-4结合时具有相同的亲和力。sIL-4R可能是IL-4保护性载体,或调节IL-4的生物学活性。
4.IL-4的生物学活性 IL-4对于B细胞、T细胞、肥大细胞、巨噬细胞和造细胞都有免疫调节作用。
(1)B细胞:促进SAC或抗IgM预先刺激B细胞的增殖,这一生物学功能已被用来作为检测IL-4的生物学活性。IL-4促进B细胞MHCⅡ类抗原、FcεRⅡ/CD23和CD40的表达,并增强B细胞提呈抗原能力,使免疫系统对小量抗原刺激发生免疫应答。增加FcεRⅡ/CD23(Ige Fc段低亲和力受体)的表达,并释放可溶性CD23(sCD23)/IgE结合因子(IgE-BF),与mIgE阳性细胞结合并诱导其分化,可能与促进B细胞IgE的产生有关。IL-4提高LPS刺激小鼠B细胞IgG1、IgE产生水平分别为8~10倍和10~100倍,但对IgG3分泌降低6~10倍,IgG2a、IgG2b和IgM有不同程度下降,对IgA产生无明显影响。IL-4增强IgG1和IgE水平的机理可能是:①使选择性刺激定向产生IgG1或IgE的B细胞的增殖和分化;②增加特异的重链稳定区(C[XB]H[/XB])Ig类的转换区Sμ-Sγ1结合,促进IgG1合成和分泌。IFN-γ对IL-4上述生物学功能有明显抑制作用。而IL-4则可抑制IFN-γmRNA的转录和抑制IFN-γ诱导B细胞产生IgG2a。寄生虫感染时血清IgG1和IgE水平升高。此外,IL-4还可促进休止期B细胞的早期活化,从G[XB]o[/XB]期进入G[XB]1[/XB]期,细胞体积增大,并表达CD25。
(2)T细胞:IL-4是T细胞自身分泌的生长因子,如HT-2细胞系是一种IL-2依赖细胞系,IL-4可单独维持TH-2的增殖,抗IL-2和抗IL-4McAb(11B11)可分别抑制IL-2和IL-4刺激IL-2细胞的增殖作用,但相互之间无交叉抑制作用。纯化后的T细胞(CD4阳性或CD8阳性亚群)对IL-4的增殖反应还需要IL-1(或PMA)的协同作用;而IL-2单独可维持活化T细胞的增殖。表明IL-4生长信号的传递过程与IL-2有所不同。高剂量IL-4能诱导CD4-CD8+或CD4+CD8-或CD4-CD8-胸腺细胞的增殖。IL-4增强PHA刺激T细胞释放GM-CSF和G-CSF。在小鼠实验系统中,多数情况下IL-4对CTL和LAK细胞的分化有正调节作用;而对人的杀伤细胞则有时表现为负调节作用,如在人MLC中IL-4选择性地促进Th增殖,同时伴有CTL、NK和LAK功能的降低。此外IL-4还能抑制IL-2所诱导的NK白血病细胞LAK活性。最近发现,用IL-4与T细胞或B细胞温育,可降低高亲和力IL-2R位点数,但不影响低亲和力IL-2R的数量。IL-4还可刺激CD3阴性NK细胞克隆和生长。
(3)刺激肥大细胞增殖,并与IL-3有协同作用,尤其对于粘膜和结缔组织型肥大细胞体外生长是必需的。
(4)促进巨噬细胞提呈抗原和杀伤肿瘤细胞的功能,可能与调节MHCⅡ类抗原和FcR表达有关。IL-4与GM-CSF、IL-3和LPS有协同作用。IL-4可诱导外周血单核细胞分泌G-CSF和M-CSF,增强中性粒细胞介导的吞噬、杀伤活性和ADCC作用。IL-4是小鼠巨噬细胞趋化因子,并促进IL-1ra产生,但抑制单核细胞IL-1、TNF和IL-6的产生。
(5)协同CSF刺激造血细胞的增殖,与G-CSF协同增强粒细胞集落形成,协同红细胞生成素(EPO)增强BFU-E的形成。
IL-4作为肿瘤免疫调节剂已进入Ⅱ期临床试验。此外,还开始进行治疗免疫缺陷症的临床试验。由于体内、体外均证实IL-4可以抑制IL-1、IL-6和TNF分泌,并促进IL-1ra 产生,因此应用IL-4可能为治疗败血症休克提供一种新的方法。
(五)IL-5
1980年Takatsu等发现在T细胞条件培养液中,含有一种因子能替代T细胞在体外协同胸腺依赖抗原的抗体应答,称为T细胞替代因子(t cell replacing factor,TRF)。由于这种因子对B细胞和啫酸性粒细胞增殖、分化有重要调节作用,又名B细胞生长因了了-Ⅱ(b cellgrowth factor-Ⅱ,BCGF-Ⅱ),IgA增强因子(IgA-enhancingfactor,IgA-EF),嗜酸性粒细胞集落刺激因子(eosinophilcolony-stimulating factor,Eo-CSF)和嗜酸性粒细胞分化因子(eosinophildifferentiation factor,EDF)。1986年统一命名为白细胞介素-5(interleukin 5,IL-5)。
1.IL-5的产生 在人类IL-5主要由活化T细胞产生,在小鼠则由Th2亚群细胞产生。
2.IL-5的分子结构和基因 1986年Kinashi获得IL-5cDNA克隆。小鼠IL-5由133氨基酸残基组成,含21氨基酸的信号肽,成熟IL-5分子含有112氨基酸残基,裸肽分子量12~15kDa,有3个糖基化位点,糖基化后分子量为18kDa,糖基化对于IL-5活性表达以及与相应受体的结合起重要作用。小鼠IL-5通常以二硫键连接的二聚体形式存在,分子量为45kDa。人的IL-5由134氨基酸残基组成,含22氨基酸残基信号肽,2个糖基化点,人和小鼠IL-5基因分别定位于第5号和第11号染色体,与IL-3、IL-4、GM-CSF等造血因子的基因密切连锁。人和鼠IL-5在氨基酸水平上有70%的同源性,生物学作用有交叉反应。
3.IL-5受体 小鼠IL-5由α和β两条链组成。α链,p60,含415个氨基酸,糖蛋白,先导序列17个氨基酸,胞膜外区322氨基酸残基,空膜区22个,胞浆区仅54个氨基酸残基。α链单独结合IL-5为低亲和力,参与信号的转导;β链,p130,单独不结合IL-5,与α链共同组成高亲和力受体。小鼠IL-5Rβ与IL-3R的β链(AIC2B基因产物)相同,人IL-5Rβ链是与IL-3Rβ链、GM-CSFRβ是共同的。由于mRNA剪接的不同,已发现有二种可溶性小鼠IL-5Rα链,其中一种可抑制IL-5与膜结合IL-5R的结合。人和鼠IL-5Rα链有79%的同源性。
4.IL-5的生物学活性 与其它IL相比,IL-5生物学活性作用谱相对较窄。
(1)小鼠IL-5促进抗原刺激的B细胞分化为抗体合成细胞,主要作用于进入细胞增殖后期的B细胞,并增加活化B细胞IL-2R的表达,IL-5的这种刺激作用与人IL-6功能相似,人IL-5只作用于B细胞刺激后很窄的时相内。
(2)促进IgA合成,其机理可能是:①作为IgA特异性启动因子,使mIgM 阳性B细胞分化为mIgA阳性B细胞;②作用于IgA型B细胞,促进其增殖和分化,成为分泌IgA的浆细胞。IL-4有协同IL-5促进IgA合成的作用。IL-5对IgM的分泌也有促进作用。
(3)协同ConA或IL-2诱导胸腺中杀伤性T细胞前体(CTPp)分化为CTL。
(4)趋化人嗜酸性粒细胞,延长成熟嗜酸性粒细胞的存活时间,刺激人和小鼠嗜酸性粒细胞的功能,诱导嗜酸性粒细胞的分化。
(六)IL-6
1980年发现成纤维细胞经Poly I-C刺激后能产生一种抑制病毒复制的细胞因子,称为β2干扰素(IFN-β2)。以后的研究结果未能证实这种因子的直接抗病毒作用,但具有其它多方面的生物学功能,根据实验系统和功能的不同,不被命名为杂交瘤/浆细胞瘤生长因子(hybri-doma/plasmacytoma growthfactor,HPGF),B细胞分化因子(B cell differentiationfactor,BCDF),B细胞刺激因子-2(b cellstimulatory factor 2,BSF-2),26kDa,溶细胞性T细胞分化因子(cytolytic T cell differentiation factor,CDF)和肝细胞刺激因子(hepatocyte stimu-lating factor,HSF)等。1986年统一命名白细胞介素6(interleukin 6,IL-6)。
1.IL-6的产生 淋巴样和某些非淋巴样细胞均可产生IL-6。
(1)T细胞:T细胞产生IL-6依赖于巨噬细胞或PMA。抗原提呈细胞刺激相应的T细胞克隆,以及HTLV-I感染的T细胞系等均可分泌IL-6。
(2)B细胞:如SAC刺激而活化的B细胞。
(3)单核细胞:LPS刺激单核细胞产生IL-6,某些单核细胞系如P388D1也可分泌IL-6。
(4)成纤维细胞:可自发产生IL-6,其它因子或刺激物如IL-1、TNF、PDGF、IFN-β、PolyI-C、A23187、PMA等可促进IL-6的产生。
(5)肾小球系膜细胞、角朊细胞、内皮细胞等在一定培养条件下均可产生IL-6。此外,肿瘤细胞或细胞系如MG63成骨肉瘤,T24膀胱癌、A549肺癌、7860肾癌、SK-MG-4神经胶质母细胞瘤、U373星状细胞瘤、心脏粘液瘤细胞和骨髓瘤细胞等也能分泌IL-6。最近发现垂体前叶中的滤泡—星状细胞(folliculostellate)可产生IL-6,可能与败血症时LPS刺激导致GH、ACTH等激素水平升高有关。
IL-1、TNF、IFN-β、PDGF、LPS、Poly Ⅰ-C、A23187和PMA等对IL-6的产生具有正调节作用。
2.IL-6的分子结构和基因 1985年Kishimoto等从人T细胞中首先获得IL-6cDNA克隆成功,人IL-6基因与小鼠有65%同源性。人IL-6基因位于第7号染色体,长约5kb,有5个外显子和4个内含子。
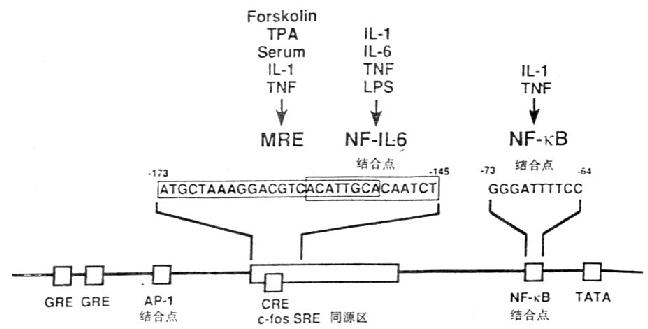
图4-1 IL-6基因的功能调节区
在IL-6基因功能调节区基因中存在着儿种转录控制元件(transcriptional control element),如糖皮质激素反应元件(glucocorticoidresponsive elements,GRE)、AP-1结合位点、c-fos血清反应元件同源物(c-fos serum responsiveelement homology,c-fos SRE homology),cAMP反应元件(cycli AMp responsive element,CRE)和NF-κB结合位点。IL-1、TNF等细胞因子可使IL-6启动子很快发生一过性的活化。IL-1反应的元件在IL-6启动基中-180/-123;IL-6核因子(NF-IL-6)识别一段特殊的14bp,ACATTGCACAATCT。多反应元件(multi-responseelement,MRE)位于c-fos SRE同源区内,这个区域对IL-1、TNF、forskolin和PMA诱导IL-6产生有关;与IL-1、TNF刺激IL-6产生有关的NF-κB位于TATA盒的上游。
人IL-6分子由212个氨基酸残基组成,包括28个氨基酸残基的信号序列,成熟IL-6为184氨基酸残基,分子量26kDa。IL-6分子由4个α螺旋和C端(175~181位氨基酸)受体结合点所组成,其中179位精氨酸残基对于与受体的结合非常重要。分子中糖基对生物学活性功能并非必需,N端23个氨基酸残基虽不直接与IL-6生物学活性有关,但对整个IL-6分子组成起稳定作用。人IL-6氨基酸序列与小鼠IL-6有42%同源性,人的IL-6对小鼠某些细胞有刺激作用。IL-6与G-CSF和IFN-β有较高同源性,对骨髓造血细胞和髓样白血病细胞的某些作用也有相似之处。
3.IL-6的受体 目前已知,IL-6R至少由称之为IL-6结合受体蛋白(IL-6binding receptor protein)和称为信号转导蛋白(signal-transducingprotein)的gp130所组成,习惯上前者称之IL-6R。
(1)IL-6R(CD126):人IL-6R由468个氨基酸组成,切除N端19个氨基酸残基后的成熟分子有449氨基酸,胞膜外区、穿膜区和胞浆区分别为339、28和82个氨基酸,分子量为80kDa,6个N糖基化位点。胞膜外由一个Ig样区(C2,约100氨基酸)、2个Ⅲ型纤维结合蛋白结构(各含100氨基酸)及1个细胞因子受体的同源区所组成,后者含4个保守的Cys和一个WSXWS结构。单独IL-6R与IL-6结合为低亲和力。IL-6R分布于淋巴样细胞和非淋巴样细胞,如活化B细胞、EBV转化B细胞、急性淋巴母细胞白血病细胞、骨髓瘤细胞、静止T细胞、肝细胞、单核细胞、急性髓样白血病(AML)细胞、嗜铬细胞瘤细胞等。
(2)gp130(CDw130):分子量为130kDa的糖蛋白,共有14个潜在N-糖基化位点,胞膜外区、穿膜区和胞浆区分别有597、22和277个氨基酸。胞膜外区有1个IgC2区,6个Ⅲ型纤维结合蛋白的结构,其中第二个和第三个结构区之间有4个保守的Cys和WSXWS结构的区域,形成1个细胞因子受体家族结构特征的结构域。gp130不能直接与配基IL-6结合,在生理情况下,IL-6与IL-6受体结合后使IL-6R的构象发生变化并迅速与两个gp130分子结合,形成高亲和力的结合位点,并通过gp130亚单位传递信号。人和小鼠gp130在氨基酸水平上有77%的同源性。转染gp130cDNA小鼠pro-B细胞在IL-6/sIL-6R复合物刺激下可传递增殖信号。小鼠体内注射IL-6可增加gp130mRNA的表达。目前已证实,gp130除组成IL-6高亲和力受体外,也是白血病抑制因子(LIF)、抑瘤素M(OSM)、睫状神经营养因子(CNTF)和IL-11等受体所共用的亚单位。
(3)信号转导:gp130与IL-6/IL-6R复合物结合后,刺激gp130胞内部分发生酪氨酸磷酸化,目前关于参与此过程的酪氨酸蛋白激酶的作用还不清楚。酷氨酸激酶被激活后继而引起丝氨酸/苏氨酸激酶如丝裂原活化的蛋白激酶(mitogen activated proteinkinase,MAPK)的激活,使NF-IL-6中丝氨酸和苏氨酸磷酸化而被激活,从而促进相应基因的活化。
(4)sIL-6R:存在于正常人尿、骨髓瘤细胞系U266培养上清,PHA活化人PBMC以及HTLV-I阳性细胞也能分泌sIL-6R,分子量为50kDa。用反转录PCR从正常人细胞和骨髓瘤细胞中均分离出编码sIL-6r mRNA,序列分析表明与膜结合受体相应区域序列一致。sIL-6也可从膜结合的sIL-6R(mIL-6)脱落而来。sIL-6R与IL-12p40亚基具有高度同源性,而IL-6与IL-12的p35亚基序列高度同源。因此可以推测类似于IL-6/sIL-6R复合物的IL-12分子可能也通过类似于pg130分子作用于细胞。与其它可溶性细胞因子受体不同,sIL-6R结合IL-6后可与细胞膜表面gp130结合,增强IL-6的刺激活性。而可溶性gp130(sgp130)可抑制sIL-6R/IL-6复合物的活性。sIL-6R水平的升高与某些自身免疫性疾病有关。
4.IL-6的生物学活性
(1)刺激细胞生长:IL-6可促进多种细胞的增殖,如B淋巴细胞杂交瘤、浆细胞瘤、EBV转化的B细胞、T细胞、PMA和IL-4刺激的胸腺细胞、造血干细胞、角朊细胞和肾小球系膜细胞。
(2)促进细胞分化:如B细胞分化和Ig的分泌,CTL分化,协同IL-2增强CTL中穿孔素基因的表达,并增加T细胞IL-2产生和IL-2R表达,诱导异巨噬细胞、神经细胞和NK细胞分化。协同IL-3促进干细胞分化和巨核细胞的成熟。明显促进小鼠骨髓移植后免疫功能的重建。
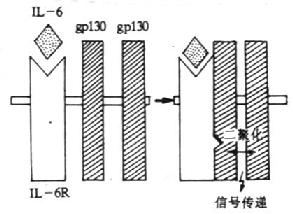
图4-2 IL-6受体信号传递的模式图
(3)加速肝细胞急性期蛋白(acute phase protein)的合成。
(4)抑制M1髓样白血病细胞系的生长,促进其成熟和分化;抑制黑素瘤、乳腺癌细胞生长。
5.IL-6与临床 IL-6与临床上多种疾病的发生有一定的关系。
(1)IL-6与自身免疫性疾病
①心脏粘液廇:患者往往表现为高丙球蛋白血症,有多种血身抗体以及急性期蛋白升高。培养的粘液瘤细胞含有IL-6和IL-6mRNA,患者血清中IL-6明显升高,骨髓中可见有IL-6依赖的多克隆浆细胞增殖。手术后上述症状和体症可见逐渐消退。
②Castleman氏病:患者表现为高丙球蛋白血症,急性期蛋白和血小板升高,增生的淋巴结生发中心中B淋巴样细胞产生IL-6,其中某些患者可发展成为多发性骨髓瘤。
③类风湿性关节炎:表现为多克隆性浆细胞增多症,自身抗体、C反应蛋白(CRP)和血小板升高。急性期血清以及关节的滑液中能测到IL-6,滑液中IL-6与IgG以及血清中IL-6与C反应蛋白之间有明显的相关性。患者的T细胞、B细胞、滑膜细胞以及软骨细胞均可产生IL-6。
④艾滋病:与艾滋病患者多克隆B细胞活化有关,HIV感染诱导单核细胞产生IL-6可能引起血清中IL-6水平的升高。此外,IL-6可能是Koposi氏肉瘤的主要生长因子之一,反义IL-6基因在体内可抑制Koposi氏肉瘤细胞的生长。
(2)IL-6与肿瘤
①浆细胞瘤形成:慢性炎症诱导IL-6生物合成增加与浆细胞瘤的发生有关。如用石腊或降植烷腹腔刺激小鼠,诱导炎症,可诱导出较高比例的浆细胞瘤。在患者也可见到类似情况,如早先发生的类风湿性关节炎可能与浆细胞瘤形成有关。在体外,IL-6可促进浆细胞瘤和骨髓瘤细胞的生长,某些浆细胞瘤细胞生长依赖于IL-6的存在。
②可能通过自分泌机理与非Hodgkin氏淋巴瘤、慢性淋巴细胞白血病和急性髓样白血病的发病有关。血清中IL-6水平与多发性骨髓瘤如浆细胞白血病病情严重程度有关。多发性骨髓瘤患者不仅骨髓细胞表面IL-6R表达增加,而且血浆中sIL-6R水平明显升高。
(3)IL-6与膜增生性肾小球肾炎(mesangial proliferativeglomerulonephritis,MPG):MPG患者尿中可测出IL-6,而且其水平与疾病的发展有关。体外培养的患者肾小球膜细胞可产生IL-6,提示MPG发生与IL-6的自分泌有关。
IL-6转基因小鼠可出现某些与临床上相似的变化,如血清中高浓度的IL-6和IgG1,浆细胞增多症,MPG的发生以及骨髓中巨核细胞的成熟。
(4)烧伤和术后伴有血清IL-6水平增加。
(5)病毒性脑膜炎和脊髓膜炎小鼠的胶质细胞可分泌大量IL-6,IL-6又可促进脑胶质细胞分泌其它神经营养因子和神经生长因子。
(6)IL-6作用于下丘脑-垂体-肾上腺轴,刺激ACTH和皮质激素的释放以及星状细胞合成内啡肽。
IL-1和TNF-α对IL-6引起的病理损伤可能有协同作用。
应用IL-6治疗放疗、化疗所致血小板减少症、癌症以及作为疫苗佐剂已进入临床试验。
(七)IL-7
1982年Whitlock建立了骨髓长期培养系统(LTBMC),使得人们有可能对B细胞前体的增殖和分化进行深入的研究。由于B细胞前体的生长对于基质细胞有严格的依赖性,推测骨髓基质细胞可能分泌一种B细胞前体细胞的生长刺激因子。1988年Namen等应用LTBMC获得一株SV40病毒转染的骨髓基质细胞株(bone marrow stromal cell line)IXN/A6,能分泌一种前B细胞刺激因子,起初命名为淋巴细胞生长素(lymphopoietin-1,LP-1),或小鼠前B细胞生长因子(murine pre-B cell growth factor),1988年统一命名为IL-7。
1.IL-7的产生 由骨髓基质细胞和胸腺基质细胞产生,以IL-7 cDNA为探针,在小鼠胸腺、脾、肾、肝等细胞中均测得有IL-7mRNA存在,但大小不一。
2.IL-7的分子结构和基因 天然IL-7分子量约为25kDa,在69和90位氨基酸残基有N糖基化点,分子内有6个半胱氨酸,可能参与链内二硫键的形成,对IL-7的生物学活性起重要作用。1988年Namen等用IXN/A6细胞株建立cDNA文库,筛选出IL-7的cDNA,经克隆后COS-7细胞中表达出有活性IL-7。小鼠IL-7前体有154氨基酸残基,25氨基酸残基的信号肽,成熟的IL-7由129氨基酸残基组成,推算裸肽分子量为14.9kDa,小于天然IL-7,但活性类似。1989年Goodwin以小鼠IL-7cDNA为探针,从人肝癌细胞系cDNA文中,获得与小鼠IL-7 cDNA高度同源的人IL-7cDNA克隆,并在COS细胞中得到表达。人IL-7基因定位于第8号染色体。rHuIL-7分子有177个氨基酸,包括25个氨基酸先导序列,成熟IL-7分子有152个氨基酸,裸肽分子量17.4kDa,与小鼠IL-7有60%同源性。IL-7对pH改变(pH2.1~8)、SDS、热等理化因素均有一定的抵抗。
3.IL-7受体 IL-7依赖的小鼠IXN/2b基质细胞表面存在高亲和力(Kd~1×10[SB]-10[/SB]M)和低亲和力(Kd~4×10[SB]-8[/SB]M)两种类型受体。每个细胞约有2000~2500个受体,其中15~20%为高亲和力型。在Pre-B、胸腺细胞、部分T细胞株上和某些巨噬细胞肿瘤细胞株上有IL-7R,成熟B细胞上无IL-7R表达。不成熟B细胞前体所表达的IL-7R与酪氨酸激酶信号转导途径密切相关,酪氨酸磷酸化是IL-7R介导的跨膜信号产生和传递过程中必不可少的步骤。现已发现一种由于mRNA的不同剪接所产生的可溶性IL-7R,可有效地结合IL-7,可能是IL-7是一种抑制物。最近研究表明,IL-7R属于红细胞生成素受本超家族成员,并有1个Ⅲ型纤维粘连蛋白结构域。
4.IL-7的生物学活性 人IL-7可作用于小鼠的前B细胞,小鼠IL-7对人前B细胞则无刺激作用。目前所知IL-7的主要生物学活性有以下几方面。
(1)B细胞:刺激Pre~B细胞(B220+)的生长,TGF-β对此有抑制作用,但不被抗IL-4、抗IL-6McAb以及抗IL-2R、IL-3R和IL-5R的McAbs所抑制。对骨髓中淋巴干细胞的分化可能也有刺激作用。纯化IL-7在10[SB]-13[/SB]M即可刺激IXN/2b细胞增殖。
(2)胸腺细胞:促进胸腺中CD4-CD8-和CD4+CD8+细胞亚群的增殖。
(3)T细胞:促进混合淋巴细胞培养(MLC)或PMA刺激T细胞的增殖,协同ConA刺激T细胞产生IL-2以及IL-2R和ICAM-1的表达。IL-7诱导T细胞增殖可通过IL-2依赖和不依赖两种途径。
(4)诱导人PBMC产生LAK活性,加入IL-2抗血清对LAK活性无显著变化,表明IL-7这种诱导LAK活性作用不依赖IL-2,IL-7诱导LAK的前体细胞主要来血PBMC中的NK。IL-4对这种诱导作用有抑制效应,抗IL-4抗血清可使IL-7诱导LAK活性提高4~10倍。
(八)IL-8
见本节趋化因子。
(九)IL-9
1988年Uyttenhove等报道了一种来自小鼠T细胞的细胞因子,能支持某些Th细胞克隆的生长,分子量在30~40kDa,又称T细胞生长因子-Ⅲ(t cellgrowth factor Ⅲ,TCGF-Ⅲ)或P40。人IL-9最初是从HTLV-Ⅰ感染的T细胞系培养上清中发现的,能刺激人巨核细胞白血病细胞株Mo7e的增殖。1990年命名为IL-9。
1 .IL-9的产生 IL-9由活化T细胞(主要是CD4+T细胞)产生,PHA或抗CD3McAb、Ca[SB]2+[/SB]载体可诱导T细胞分泌IL-9,PMA有协同作用。PMA和Ca[SB]2+[/SB]载体刺激人PBMC可转录大量IL-9mRNA。此外,HTLV-I转化的T细胞株C5MJ2细胞、肥大细胞也可产生IL-9。目前还没有检测到静止T细胞或活化B细胞中有IL-9mRNA的表达。
2.IL-9的分子结构和基因 人和小鼠IL-9基因结构相似,在DNA水平上有67%同源性。人IL-9基因由5个外显子和4个内含子组成,基因长约4kb,与IL-3、IL-4、IL-5、M-CSF、GM-CSF、c-fms、PDGFR基因位于第5号染色体中,在小鼠位于13号染色体。IL-9基因5′非翻译区(UTR)含有TATA盒以及活化蛋白(activator protein,AP)1、2和3,NF-κB,specificity protein-1(SP-1)位点和糖皮质激素反应元件(GRE)等识别位点。小鼠IL-9分子的前体由144个氨基酸残基组成,含18个氨基酸残基的信号肽。人成熟IL-9由126个氨基酸残基组成,分子量为14.2kDa。人和小鼠IL-9在氨基酸水平的56%同源性。均含有10个保守的半胱氨酸,在生理情况下可能形成复杂的二硫键。IL-9为碱性蛋白,有多个N糖基化点。
3.IL-9受体 IL-9R结构上属于红细胞生成素受体超家族(ERS),与配体结合为高亲和力。小鼠IL-9R含468个氨基酸,人IL-9R为553个氨基酸,两者有53%同源性。在小鼠已发现有缺乏空膜区和胞浆区的可溶性IL-9受体(sIL-9R)。
4.IL-9的生物学功能 与其他的细胞因子不同,小鼠IL-9可作用于人的细胞,而人的IL-9却对小鼠细胞无刺激活性。
(1)维持T细胞生长,为一种自分泌生长因子,因此又称为T细胞生长因子-Ⅲ(TCGF-Ⅲ)。由于抗CD3McAb能诱导IL-9产生,故推测IL-9对T细胞抗原刺激后启动的免疫应答有重要调节作用。
(2)IL-9对于IL-4诱导PBL中正常B细胞IgG、IgE和IgM的产生有促进作用。
(3)小鼠IL-9协同IL-3或IL-4刺激骨髓来源肥大细胞的增殖,并诱导其产生IL-6。
(4)刺激巨核母细胞白血病细胞的生长。此外,人和鼠IL-9均可与EPO协同,支持体外骨髓细胞红细胞系的爆发形成单位(erythroid burst forming units,BFU-E)的产生。IL-9单独能支持BFU-E的短期存活。
IL-9可能与Hodgkin氏病的发生有关。原代或传代培养的Hodgkin氏瘤和Reed-Sternberg细胞表达IL-9和IL-9R。
(十)IL-10
1989年美国DNAX研究所Fiorentino等发现小鼠Th2细胞株D10.G4.1产生一种新的细胞因子,能抑制Th1细胞株细胞因子mRNA的转录,称为细胞因子合成抑制因子(cytokine synthesis inhibitory factor,CSIF),同年命名为白细胞介素10(interlenkin 10,IL-10)。
1.IL-10的产生 抗原或丝裂原刺激小鼠Th2细胞株D10.G4.1以及CDC25、CDC35、D9、MB2-1等细胞可分泌IL-10。在小鼠,活化胸腺细胞、巨噬细胞、角朊细胞、Ly1+(CD5+)和正常B细胞也可产生IL-10;在人类,某些CD4+T细胞克隆、来自AIDS病人B细胞系、EBV感染的淋巴母细胞、Burkitt氏淋巴瘤、活化单核细胞、外周血T细胞(包括CD8+细胞,CD4+CD45RA+naive T细胞、CD4+CD45RO+记忆T细胞)均可产生IL-10。
2.IL-10的分子结构和基因 小鼠和人IL-10基因都定位于第1号染色体,其基因组包括5个外显子和4个内含子,并可能有NF-κB和AP-1的结合位置。人和小鼠IL-10在DNA和氨基酸水平上分别有81%和73%的同源性。DNA序列分析表明,IL-10与EB病毒基因组中开放读框区I(BCRF-I)有70%左右的同源性。有人把BCRF-I的基因产物称为病毒IL-10(vIL-10),提示EBV可能摄取了哺乳动物IL-10的基因,以求自身的生存。如EBV感染过程中通过产生vIL-10抑制宿主细胞IFN-γ产生,保持EBV在宿主细胞内生存和繁殖。Moore等已克隆成功IL-10cDNA,并在COS7细胞中得到表达。人和小鼠IL-10均含178个氨基酸残基,内有18氨基酸信号肽系列,裸肽分子量18.7kDa,PI8.1。成熟IL-10分子为160氨基酸残基,小鼠和人IL-10分子中分别含5个和4个半胱氨酸残基,由于不同糖基化可使分子量有所差别,在35~40kDa之间,酸性条件下不稳定,在溶液中呈非共价连接的同源双体。人IL-10可作用于小鼠源性细胞,而小鼠IL-10对人的细胞则无作用。
3.IL-10的生物学功能
(1)抑制小鼠Th1细胞的增殖以及IL-2、IL-3、IFN-γ、TNF以及GM-CSF等细胞因子合成。其作用机理可能是IL-10作用于APC细胞,降低其MHCⅡ类抗原的表达,或诱导APC细胞产生另一种细胞因子,改变细胞内信号的传递途径,从而选择性抑制某些细胞因子mRNA转录。IL-10可抑制人TH0、TH-1、TH-2样T细胞克隆的增殖。
(2)促进肥大细胞和胸腺细胞增殖,IL-10也是淋巴结、脾脏细胞生长的复合因子(cofac-tor)。
(3)协同IL-2诱导ConA活化脾细胞中CTL前体细胞(CTLp)分化为成熟的CTL。
(4)提高B细胞的存活率,促进B细胞的增殖、MHCⅡ类抗原表达以及Ig的分泌,并与Th2所产生的IL-4、IL-5有协同作用。
(5)抑制NK细胞因子的产生。
IL-10的拮抗剂可能具有抗EB病毒的作用;而IL-10通过促进单核细胞表达IL-1ra而可能成为抗炎症的治疗手段,动物实验表明,IL-10可有效地避免LPS诱导小鼠休克而造成的死亡。
(十一)IL-11
IL-11最初由Paul等在灵长类动物骨髓基质细胞株Pu-34培养上清发现的。这种生长因子可刺激IL-6依赖的小鼠浆细胞瘤细胞系T1165.85.2.1的生长,即使在有中和活性抗IL-6McAb的存在,仍有这种刺激作用,以后证实这种因子与脂肪形成抑制因子(adipogenesisinhibitory factor,AGIF)是同一物质。1990年命名为白细胞介素11(interleukin 11,IL-11)。
1.IL-11的产生 主要由间充质来源的粘附细胞(mesenchymal-derived adherent cell)产生,如骨髓基质细胞、基质成纤维细胞、人胚肺成纤维细胞和滋养层细胞。IL-1刺激Pu-34细胞后IL-11明显升高。
2.IL-11的分子结构和基因 杨育中等首先发现并克隆人IL-11基因,至今小鼠IL-11基因尚未克隆成功。人IL-11基因定位于19号染色体,含有5个外显子和4个内含子。在5′UTR含有与RNA多聚酶Ⅱ结合的TATA盒;3′UTR含有多个ATTTA重复序列,可能与降低mRNA的稳定性有关;此外,还有一些序列可能与干扰素诱导元件(或因子)(interferon-inducible elements或interferon-induciblefactors)如SP-1(specificityprotein 1 或promotor-specific factor)和AP-1(activator protein 1)相结合。成熟的人IL-11分子含178个氨基酸残基,分子量23kDa,不含半胱氨酸残基,亦无潜在的糖基化位点。
3.IL-11受体 迄今为至特异性结合IL-11的人IL-11受体α链尚未基因克隆成功。PU34细胞每个细胞有138个IL-11结合位点,亲和力Kd为1.2×10[SB]-10[/SB]M。目前已经证实,gp130是IL-11受体的信号转导亚单位,gp130是IL-11R以及IL-6R、LIFR、OSMR、CNTFR所共有的。IL-11可诱导靶细胞的酷氨酸磷酸化,gp130中和活性抗体可抑制IL-11诱导的酷氨酸磷酸化。有关gp130的基因的分子的结构参见本节IL-6受体和本章第三节。1994年Hilton等从成年小鼠肝cDNA文库中克隆成功小鼠IL-11Rα链cDNA,与IL-6Rα链有24%同源,属于造血因子受体家族。
4.IL-11的生物学活性 IL-11的功能与IL-1、IL-6、G-CSF和SCF的功能相近。
(1)促进B细胞抗体的生成,这一作用依赖于CD4T细胞的存在。体内实验证明,IL-11可使小鼠脾脏抗原特异性PFC水平和血清中特异性抗体升高。
(2)促进某些IL-6依赖细胞株如TF-1的生长,IL-11与IL-6可诱导靶细胞产生相似的蛋白酪氨酸磷酸化以及原癌基因jun-B的表达。
(3)与IL-3、IL-4协同作用于骨髓造血干细胞,缩短干细胞Go期。
(4)与IL-3等协同促进骨髓巨核细胞体外集落形成、生长和成熟,并增加细胞体积,增加外周血血小板的数量。
(5)IL-11对小鼠骨髓和胎儿肝脏来源的不同分化阶段红系祖细胞具有刺激作用,在早期阶段需要与IL-3或SCF协同,而在分化晚期,IL-11单独可促进CFU-E的成熟。
(6)诱导肝细胞急性期蛋白合成。
(7)抑制脂蛋白脂酶(lipoprotein lipase,LPL)活性和脂肪细胞的分化,因此,又称为脂肪形成抑制因子(AGIF)。
小鼠体内应用IL-11可诱导抗体产生细胞的产生,血小板升高,增加骨髓来源CFU-GM、BFU-E、CFU-GEMM祖细胞细胞周期的速率。在骨髓抑制的小鼠中,IL-11可促进外周血中血小板、红细胞和粒细胞的数量。在骨髓移植小鼠中,IL-11可明显促进外周血中性粒细胞和血小板水平的恢复。
(十二)IL-12
1982年Wagner等发现在丝裂原刺激小鼠淋巴细胞的条件培养液中存在一种不同于IL-2的细胞因子,这种细胞因子在体外能与IL-2协同促进鼠CTL应答。1986年在人混合淋巴细胞培养(MLC)或PHA活化的PBMC培养上清中也发现了与此类似的因子,称为CTL成熟因子(cytotoxic lymphocyte maturationfactor,CLMF;或Tc maturation factor TcMF)。1991年Gubler等将CLMfcDNA克隆并表达成功,表明是一种新的细胞因子,遂将CLMF命名为白细胞介素12(interleukin 12,IL-12)。
1.IL-12的产生 主要由B淋巴细胞产生。
(1)MLC或丝裂原活化的PBMC培养上清。
(2)PMA与钙离子载体A23187联合刺激EBV转化的B淋巴样母细胞RPMI8866可产生较高水平的IL-12。
2.IL-12的分子结构和基因 IL-12是由二硫键联接的异源双体,两个亚单位的分子量分别为35kDa和40kDa,等电点在pH4.5~5.5。从高产IL-12的人B淋巴样母细胞亚克隆NC37.98基因文库中克隆了IL-12cDNA,转染COS细胞获得高表达。人IL-12P35亚单位有197个氨基酸残基,含7个半胱氨酸和3个N糖基化位点,P40亚单位306个氨基酸残基,有10个半胱氨酸,4个N-糖基化位点。小鼠IL-12P35有193个氨基酸残基,与人IL-12P35有66%同源性,P40有313个氨基酸残基与人P40有70%同源性。在生理情况下,亚单位中的半胱氨酸残基之间可能形成复杂的分子间二硫键结构。两个亚单位是由不同的基因所编码,基因转染试验结果表明,只有将编码两个亚单位cDNA同时转染才能获得有生物学活性的IL-12。P35与IL-6和G-CSF有同源性,P40与IL-6受体、睫状神经营养因子(CNTF)受体、G-CSF受体有同源性,具有细胞因子受体家族的特征。提示IL-12分子可能是一种细胞因子/可溶性细胞因子受体复合物。在RPMI8866细胞系中纯化到的自然杀伤细胞刺激因子(natural killer cell stimulating factor,NKSF)的结构和功能与IL-12相同。
3.IL-12受体 IL-12R亚单位的基因最近克隆成功,推算有662个氨基酸,裸肽分子量70kDa,糖基化后约为100kDa。IL-12R亚单位为Ⅰ型穿膜蛋白,胞膜外区含516个氨基酸残基,与gp130、G-CSFR、LIFR高度同源。单体IL-12R不结合IL-12,双体或寡聚体IL-12R亚单位与IL-12(p40亚单位为与受体结合部位)结合为低亲和力,Kd为2~6nM,PBMC表面有IL-12高亲和力受体,Kd约100pM,目前与IL-12R亚单位组成高亲和力的另一个亚单位尚未确定。IL-12P35亚单位、P40亚单位和IL-12R亚单位分别与IL-6、IL-6R和gp130有很高的同源性,而且相互结合的模式也十分相似,即IL-12P35同P40形成异源双体后可同双体或寡聚体的IL-12R亚单位结合,而IL-6同IL-6R受体结合后可同gp130二聚体结合。IL-12受体分布于PHA活化的CD4+、CD8+T细胞亚群以及IL-2活化的CD56+NK细胞,1000~9000IL-12结合点/细胞。
4.IL-12的生物学功能 人IL-12作用有种属特异性,人IL-12对小鼠细胞作用甚微。
(1)与IL-2协同诱导CTL的分化,促进同种异体CTL反应。
(2)刺激PHA活化CD3+T细胞(包括CD4+和CD8+)增殖。IL-12诱导T细胞最大增殖水平低于IL-2的增殖刺激作用,但刺激50%最大增殖所需细胞因子浓度远低于IL-2。IL-12这种增殖作用所经途径与IL-2、IL-4和IL-7的刺激作用不同,因为针对IL-2、IL-2R、IL-4和IL-7的单克隆抗体不能阻断IL-12的增殖作用;IL-12单克隆抗体对IL-2、IL-4和IL-7诱导增殖亦无阻断作用。IL-12对静止PBMC不具有增殖作用,这一性质与IL-4相似。但IL-12与亚适剂量IL-2可协同诱导静止PBMC增殖。其机理可能是:①IL-12促进IL-2诱导T细胞IL-2r P55的表达,提高PBMC对IL-2的反应性;②IL-2促进PBMC某些亚群IL-12R表达;③在IL-2存在的条件下,IL-12可提高IFN-γmRNA转录水平,增加其稳定性,促进分泌IFN-γ,如小鼠IL-12可诱导Th1细胞产生IFN-γ。此外,IL-12通过诱导产生的IFN-γ激活巨噬细胞,诱导其TNF-α的分泌。IL-12可诱导Th1亚群的形成,此作用可能通过两种途径:①IL-12直接作用于Th1亚群;②IL-12刺激T细胞、NK细胞产生IFN-γ诱导Th1亚群形成。
(3)协同IL-2诱导CD56+NK细胞增殖以及LAK细胞产生,促进ADCC功能,NKSF释放,诱导CD56、CD2、CD11a、IL-2R、TNFR(CD120b)、LFA-1和ICAM-1等分子的表达。
(4)促进B细胞Ig产生和Ig类型转换,由IgM转为IgG,抑制IL-4诱导B细胞IgE合成。这种抑制作用是T细胞依赖的,其作用机理与IFN-γ、TGF-β和IL-8抑制IgE产生的机理可能有所不同。
IL-12发挥生物学效应所需的细胞因子浓度很低(≤pM),与亚适剂量IL-2联合应用可降低IL-2用量,同时提高CTL、NK、LAK的杀伤活性,因此IL-12可能成为一种新的抗肿瘤生物制剂。
(十三)IL-13
1993年Minty等报道了白细胞介素12(interleukin 13,IL-13)cDNA克隆获得成功。IL-13主要由活化T细胞产生,抗CD28抗体可诱导IL-13mRNA表达;在小鼠IL-13由Th2亚群产生。
1.IL-13的分子结构和基因 人IL-13基因定位于5号染色体,由4个外显子和3个内含子组成。人和小鼠IL-13在基因水平上有66%同源性。人IL-13分子有132个氨基酸,切除18个氨基酸的信号肽后,成熟IL-13分子为114个氨基酸,非糖基化IL-13分子量为12.4kDa,糖基化后为17kDa,与小鼠IL-13有58%同源性。IL-13基因与IL-4基因连锁,在氨基酸水平上有20%~25%同源性。
2.IL-13的生物学活性
(1)趋化单核细胞,延长单核细胞在体外存活时间,抑制LPS诱导单核细胞、巨噬细胞IL-1、IL-6、IL-8和TNF-α等炎症因子产生。
(2)协同抗IgM活化B细胞的增殖,诱导和上调B细胞MHCⅡ类抗原、CD23和CD72的表达,诱导B细胞产生IgM、IgG和IgE。
(3)诱导大颗粒淋巴细胞(LGL)产生IFN-γ,并可与IL-2协同刺激LGL产生IFN-γ,因而在诱导LAK活性以及Th1型细胞免疫中可能有重要作用。
(十四)IL-14
白细胞介素14(interleukin 14,IL-14)又称高分子量B细胞生长因子(high molecular-weight B cell growthfactor,HMW-BCGF)。成熟IL-14有468个氨基酸,单体形式,主要由T细胞产生,可诱导活化B细胞的增殖,但对静止B细胞无刺激作用,抑制有丝分裂原刺激的B细胞Ig的分泌。
(十五)IL-15
Grabstein等首先在猴肾表皮细胞系CV-1/EBVA上清中发现一种能维持CTLL增殖的因子,随后基因克隆获得成功并命名为白细胞介素15(interleukin 15,IL-15)。以猴IL-15 cDNA为探针克隆人IL-15 cDNA获得成功,人和猴IL-15基因编码区序列有97%同源。人体多种组织和细胞表达IL-15mRNA,如心、肺、肝、肾,尤以胎盘和骨骼肌以及PBMC最为丰富,但活化的外周血T细胞却检测不到IL-15mRNA。IL-15前体分子由162氨基酸组成,先导序列较长为48个氨基酸残基,成熟分子114个氨基酸残基,分子量14~15kDa。IL-15具有类似IL-2的结构和功能,刺激CTLL细胞和PHA活化T细胞(CD4+CD8+亚群)的增殖,诱导CTL和LAK细胞的产生。IL-15的刺激作用需要有靶细胞的IL-2受体β和γ链的参与,但不需要IL-2受体的α链。
表4-3 白细胞介素(IL)种类和主要生物学活性
| IL | 主要产生细胞 | 氨基酸数目 | 分子量(kDa) | 主要生物学活性 |
| IL-1 | 单核细胞 | IL-1α159 | 17.5 | (1)促进胸腺细胞、T细胞活化、增殖和分化 |
| 巨噬细胞 | IL-1β153 | 17.5 | (2)增强CTL和NK杀伤活性 | |
| (3)协同IL-4刺激B细胞增殖、分化和Ig产生 | ||||
| (4)协同CSF促进造血功能 | ||||
| (5)刺激干细胞产生SCF | ||||
| IL-2 | 活化T细胞 | 133 | 15.5 | (1)促进活化 T细胞增殖、分化和细胞因子产生 |
| (2)增强CTL、NK和LAK杀伤活性 | ||||
| (3)促进B细胞增殖、分化和抗体分泌 | ||||
| (4)活化巨噬细胞 | ||||
| IL-3 | 活化T细胞 | 133 | 15 | (1)促进多能干细胞、定向祖细胞、髓样、红样、巨核、前单、单核、中性、嗜酸、肥大细胞增殖和分化 |
| (2)促进T细胞增殖 | ||||
| (3)增强外周血PMN、Mo、Eo的数量,促进Eo的ADCC | ||||
| IL-4 | 活化T细胞(Th2) | 129 | 20 | (1)促进活化B细胞增殖、Ig产生和类别转换为IgE和IgG1 |
| (2)T细胞生长因子 | ||||
| (3)促进肥大细胞增殖 | ||||
| (4)增强巨噬细胞功能 | ||||
| (5)协同CSF刺激造血细胞 | ||||
| IL-5 | 活化T细胞 | 115×2 | 45 | (1)诱导B细胞分化为抗体分泌细胞、IgA合成 |
| (Th2) | (2)协同IL-2促进CTL分化 | |||
| (3)促进人Eo激活、增殖和分化 | ||||
| IL-6 | 单核细胞 巨噬细胞 | 184 | 26 | (1)刺激T细胞、B细胞、杂交瘤细胞和干细胞增殖 |
| 成纤维细胞 | (2)促进B细胞Ig产生 | |||
| (3)促进CTL、NK干细胞和巨核细胞分化 | ||||
| IL-7 | 骨髓和胸腺 | 152 | 25 | (1)刺激B细胞前体、前B细胞的增殖 |
| 中基质细胞 | (2)促进前T细胞、胸腺细胞和T细胞增殖 | |||
| (3)诱导LAK活性 | ||||
| IL-8 | 单核细胞 | 69,72,77, | 8-10 | 趋化中性、嗜碱性粒细胞和T细胞 |
| 内皮细胞 | 79 | |||
| IL-9 | 活化T细胞 | 14.2 | (1)T细胞生长因子 | |
| 126 | (2)协同IL-3刺激肥大细胞 | |||
| IL-10 | 活化T细胞 | 2×160 | 35~40 | (1)抑制Th1细胞分泌细胞因子 |
| (Th2) | (2)促进胸腺细胞和肥大细胞增殖 | |||
| (3)协同IL-2促进CTL分化 | ||||
| IL-11 | 基质纤维样 | 178 | 23 | (1)促进B细胞抗体分泌 |
| 细胞 | (2)促进浆细胞瘤生长 | |||
| (3)协同IL-3等刺激骨髓干细胞和巨核细胞生长 | ||||
| IL-12 | B细胞 | 197/306 | 35/40 | (1)协同IL-2促进CTL、NK、LAK分化 |
| (2)促进PHA活化T细胞增殖 | ||||
| (3)促进B细胞Ig产生和类型转换 | ||||
| IL-13 | 活化T细胞 | 132 | 17 | (1)刺激B细胞增殖和CD23表达 |
| (2)抑制单核-巨噬细胞炎症性细胞因子产生 | ||||
| IL-14 | 活化T细胞 | 468 | - | (1)刺激活化B细胞增殖 |
| (2)抑制丝裂原诱导的B细胞Ig的分泌 |
二、集落刺激因子(CSF)
骨髓造血干细胞体外半固体培养技术的建立和重组集落刺激因子(colony-stimulating factor,CSF)的问世给集落刺激因子的研究提供了前提。根据细胞因子刺激不同造血细胞系或不同分化阶段的细胞在半固体培养基中形成不同细胞集落,分别命名为粒细胞CSF(G-CSF)、巨噬细胞CSF(M-CSF)、粒细胞和巨噬细胞CSF(GM-CSF)、多重集落刺激因子(multi-CSF,又称IL-3)、干细胞因子(SCF)、红细胞生成素(EPO)。有人将IL-5称为嗜酸性粒细胞集落刺激因子(Eo-CSF)。此外,IL-1、IL-6和IL-11在骨髓多能干细胞早期的分化中也有重要的作用。
(一)IL-3
1981年Ihle等发现ConA刺激小鼠脾细胞的培养上清中含有一种因子,能提高裸鼠脾脏淋巴细胞成熟淋巴细胞标志20-α-羟固醇脱氢酸(20-α-hydroxysterioddehydrogenase,20αSDH)的阳性率,命名为白细胞介素3(interleukin-3,IL-3)。由于IL-3可刺激多能干细胞和多种祖细胞的增殖与分化,又称为多重集落刺激因子(multi-colony stimulating factor,multi-CSF)。
1.IL-3的产生 主要由活化T细胞或T细胞克隆产生。小鼠髓样单核细系(myelomonocytic cell line) WEHI-3B细胞系可自发产生一定水平的IL-3。此外,胸腺上皮细胞、活化小鼠肥大细胞等也可表达IL-3。
2.IL-3的分子结构和基因 1984年美国和澳大利亚分别从ConA刺激小鼠T细胞和WEHI-3B细胞中提取高活性部分mRNA,逆转录成cDNA,进行克隆化和DNA序列分析。编码小鼠IL-3和GM-CSF的基因都定位于第11号染色体。IL-3的基因组由5个外显子和4个内含子组成。cDNA编码166氨基酸残基,N端26氨基酸残基为信号肽,此外N端另有数个氨基酸残基可能被血清蛋白酶所切除。成熟小鼠IL-3由131氨基酸残基组成,含有糖基,分子量为25~28kDa。
1986年美籍华人杨育中从长臂猿T白血病细胞株MLA144中提取IL-3mRNA,成功地获得长臂猿IL-3cDNA(gIL-3cDNA),后又用gIL-3cDNA作为探针筛选人IL-3基因组DNA,并克隆成功。人IL-3基因结构与小鼠相似,由5个显子和4个内含子组成,人与鼠IL-3DNA约有45%同源性,氨基酸有29%同源性,但人鼠间IL-3生物学作用无交叉反应。人和长臂猿IL-3有高度同源性,成熟的IL-3分子都由133个氨基酸残基组成,仅11个氨基酸残基不同,在第16位和84位上2个半胱氨酸残基在分子内形成二硫键,此外还有2个N糖基化点 。在体外糖基不影响IL-3的生物学活性。hIL-3启动子上游调控区含有多个转录调控子同源位点,其中AP-1(TGAGTCA)位于-301处,CREB(TTACGTCT)位于-147处,NFAT-1(GATGAATAAT)位于-156处,CK-1(GAAGGTTCCA)位于-126处,CK-2(TCAGATAA)位于-115处。hIL-3转录调控主要受上游两个顺式调控区的调控。第一个位于-121到-161之间,它对于hIL-3转录激活最为重要,其间除含有CREB、NFAT-1外,新发现了对hIL-3表达起决定作用的转录调控蛋白结合位点,该位点被命名为NF-IL-3-A(ATGAATAA)。第二个调控区位于-301处的AP-1位点,AP-1位点能强有力地增强hIL-3基因的转录。此外,最近还发现了hIL-3转录抑制调控区,位于-250和-271之间,称为NIP位点。目前认为位于其上游-301处AP-1对hIL-3的转录增强作用是通过消除NIP对hIL-3基因转录的抑制来实现的。
人IL-3以及IL-4、IL-5、IL-13、GM-CSF、M-CSF、M-CSF受体(c-fms编码产物)、PDGFR(血小板衍生的生长因子受体)、β[XB]2[/XB]-肾上腺素能受体(β[XB]2[/XB]AR)、内皮细胞生长因子(ECGF)和CD14的基因都定位于第5号染色体。这种在一定区域内连锁的现象可能与协同调节造血过程有关,并可能与骨髓发育异常综合征(myelodysplastic syndrome,MDS)、原发性急性非淋巴细胞白血病(acutenonlymphocytic leukemia,ANLL)、顽固性巨幼红细胞贫血等疾病的发病有关。
3.IL-3受体 分子量为140kDa,属于红细胞生成素受体超家族成员,而且具有2个该家族的结构域,IL-3R胞浆区是酪氨酸激酶的底物。有关IL-3Rβ链参见本节GM-CSF受体和本章第三节。
4.IL-3的生物学活性 IL-3与其它集落刺激因子的生物学作用见表4-4。除具有多重集落刺激作用外,最近发现IL-3可刺激皮肤上皮细胞、CD4-CD8-TCRαβ细胞、肥大细胞、嗜碱性粒细胞的增殖,阻止肥大细胞发生程序性细胞死亡。
(二)GM-CSF
1977年Burgess等从小鼠肺条件培养液中发现一种能刺激粒细胞和巨噬细胞形成集落的因子,命名为粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colonystimulating factor,GM-CSF)。1984年和1985年小鼠和人GM-CSF的cDNA分别克隆成功。
1.GM-CSF的产生 T细胞、B细胞、巨噬细胞、肥大细胞、内皮细胞、成纤维细胞等均可产生GM-CSF。其中T细胞和巨噬细胞一般在免疫应答或炎症介质刺激过程中直接产生;而内皮细胞、成纤维细胞可能通过IL-1和TNF的诱导而产生。
表4-4 CSF的生物学功能及临床应用
| CSF | 分子量(kDa) 鼠 人 | 主要产生细 胞 | 主要集落刺激作用 | 促进吞噬细胞功能 | 临床治疗疾病 | 使用情况 | 基因定位 | 外显子/内含子 | 人与鼠同源性(%) | 人与鼠活性交叉 | 糖基化 |
| G-CSF(CSF-β) | 25 30 | Mo,En,Fb | 髓样、中性粒细胞集落增殖、分化成熟 | PMN的吞噬和杀伤功能,ADCC | 增加化疗作用,艾滋病,白血病,再生障碍性贫血、癌症,骨髓移植 | FDA已批准 | 17q11~q13 | 5/4 | 73 | + | 0- |
| M-CSF (CSF-1) | 70 45(同源二聚体) | Mo、En、Fb | 前单核、单核 | M [img]/assets/zyimg/shu/xibaohefenzimianyixue/image044.jpg[alt][/alt][/img]吞噬和细胞毒功能,ADCC,促进IL-1、TNF-α的产生 | Ⅰ期临床试验 | 5q23~q31 | 80 | + | N- | ||
| GM-CSF(CSF-α,CSF-2) | 23 22 | Tact、Fb、En、Mo | 多能干细胞、髓样干细胞、单核、嗜酸、中性粒细胞增殖 | 增加M [img]/assets/zyimg/shu/xibaohefenzimianyixue/image044.jpg[alt][/alt][/img]、Mo、PMN、Eo的数量,提高吞噬功能 | 二次化疗所致中性粒细胞减少症,异体和自体骨髓移植,再生障碍性贫血,烫伤骨髓功能衰竭,血小板减小 | FDA已批准 | 5q23~q31 | 4/3 | 54 | - | N- |
| IL-3(multi-CSF) | 25 18 | Tact | 多能干细胞、多种定向祖细胞、前髓、髓样、红样、巨核、前单、单核、中性、嗜酸、肥大细胞 | 体内注射IL-3增加外周血中PMN、Mo、Eo的数量,促进Eo ADCC | Ⅰ、Ⅱ期临床试验 | 5q23~q31 | 5/4 | 29 | _ | N- | |
| EPO | 30 30-34 | 肾基质细胞 | 红细胞系 | 促进BFU-E、CFU-E以及红系的增殖和分化 | 贫血 | FDA已批准 | 7q11~q22 | 5/4 | 80 | + | N-/0- |
| SCF | 31×2(同源二聚体) | 肝细胞 | 干细胞、造血祖细胞、髓系、红系、巨核细胞系 | 干细胞增殖和分化,与IL-3、G-CSF、GM-CSF和EPO有协同作用 | 癌症 | Ⅰ期临床试验 | 80 |
Mo:单核细胞;M[img]/assets/zyimg/shu/xibaohefenzimianyixue/image044.jpg[alt][/alt][/img]:巨噬细胞;Eo:嗜酸性粒细胞;En:内皮细胞;Fb:成纤维细胞;Tact:活化T细胞
表4-5 产生GM-CSF的细胞和刺激物
| 细胞种类 | 刺激物 |
| 生理性GM-CSF主要来源 | |
| T淋巴细胞 | 抗原、外源凝集素、CD28McAb、IL-1、HTLV |
| B淋巴细胞 | LPS、TPA |
| 巨噬细胞 | LPS、FCS、吞噬作用、粘附作用 |
| 成纤维细胞 | TNF、IL-1、TPA |
| 内皮细胞 | TNF、IL-1、TPA、修饰的LDL |
| 间皮细胞 | EGF+TNF |
| 成骨细胞 | PTH、LPS |
| 病理性GM-CSF主要来源 | |
| AML | TNF、粘附、IL-1 |
| 类风湿性关节炎滑膜 | |
| 实体瘤 |
注:PTH:甲状旁腺激素
2.GM-CSF的分子结构和基因 人和鼠GM-CSF基因DNA序列有高度同源性,基因组约2.5kb长,包括4个外显子和3个内含子。小鼠GM-CSF基因位于11号染色体。在人则位于第5号染色体长臂,在IL-3基因下游9kb处,此外,人的IL-4、IL-5、M-CSF、M-CSF受体(C-fms)和早期生长应答基因-1(early growth response gene-1,EGR-1)也位于第5号染色体的长臂(表4-6)。
表4-6 人第5号染色体上某些生长因子、受体和CD抗原的基因
| 细胞因子 | IL-3、IL-4、IL-5、IL-13 |
| M-CSF、GM-CSF、ECGF | |
| 受 体 | M-CSFR(C-fms) |
| PDGFR、β[XB]2[/XB]AR | |
| CD抗原 | CD14、CD49a、CD49b |
| 其 它 | EGR-1 |
人和小鼠GM-CSF基因以及其它某些淋巴因子基因上游区TATA盒上游330bp有较高的同源性,包括一个富含GC的区域和一个10个核苷酸同一的序列(decanucleotideconsensus sequence),这一序列也见于人或小鼠IL-2和IL-3基因的promoter中。此外,CK-1(cytokine consensus-1)或称保守的淋巴因子元件1(conserved lymphokine element 1,CLE-1)在小鼠或人G-CSF、GM-CSF、IL-2和IL-3的基因组中均可见到;而CK-2仅见于人或小鼠GM-CSF和IL-3的基因组中。
人和小鼠GM-CSF分别由144和141氨基酸残基组成,均包含17氨基酸的先导序列。成熟的人和小鼠GM-CSF分子分别由127和124个氨基酸残基组成,在氨基酸水平上有54%同源性,但生物学作用具有种属特异性。GM-CSF含有高度保守结构的2个链内二硫键,其中51个与93位之间形成的二硫键对该因子的生物学活性有重要作用。人GM-CSF分子中第21~31和78~94氨基酸残基对刺激造血功能极为重要,而糖基无论在体内或体外对GM-CSF的生物效应似乎无影响。
用GM-CSF转基因小鼠造血细胞为研究模型,发现这类小鼠有高水平的GM-CSF,同时伴有许多细胞组织的损伤。自分泌GM-CSF的造血细胞同时转录IL-1α、TNF和FGF(成纤维细胞生长因子)mRNA。
13.GM-CSF的生物学活性 GM-CSF有多种生物学活性(表4-4和4-7)。
表4-7 GM-CSF的生物学活性
| 体外实验 | |
| 刺激细胞增殖 | 骨髓细胞,粒细胞,巨噬细胞祖细胞,红样,巨核细胞祖细胞,AML,白血病细胞系,BFU-E,内皮细胞,单核-巨噬细胞,淋巴细胞,骨髓来源树突状细胞祖细胞,成骨肉瘤细胞,腺癌细胞 |
| 促进功能 | |
| 中性粒细胞 | 存活和蛋白合成,移动抑制,氧化代谢,脱颗粒,细胞因子分泌,再循环,IgA介导吞噬作用,ADCC吞噬和杀死病原体,表面受体调变,花生四烯酸释放,白三烯和PAF合成 |
| 嗜酸性粒细胞 | 存活,细胞毒,白三烯合成 |
| 嗜碱性粒细胞 | 组胺释放 |
| 巨噬细胞 | 细胞因子合成(如IL-1、TNF-α),杀灭寄生虫,表面受体、抗原表达,杀灭肿瘤,粘附,氧化代谢 |
| 朗罕氏细胞 | 成熟,存活力和功能 |
| 体内 | |
| 促进造血,嗜酸细胞增多 | |
| 降低血清胆固醇 | |
| 髓样细胞增殖综合征 | |
| 失明和肌肉炎细胞浸润(转基因动物) |
有报导GM-CSF和IL-3的融合蛋白可明显增强造血功能,如融合蛋白PIXY321与同时表达GM-CSFR和IL-3R细胞株结合,亲和力增加5~10倍,促进细胞增殖作用是GM-CSF加IL-3作用的10倍,刺激BFU-E、CFU-E、CFU-GM、CFU-GEMM造血细胞集落作用比单独使用IL-3、GM-CSF或两者联合应用要高10~20倍。
4.GM-CSF受体 人和小鼠 GM-CSFR均由α、β两条链组成,单独α链与配体的结合为低亲合力,β链单独不结合配体,但与α链共同组成高亲和力受体,在信号转导中起主要作用。GM-CSFR。α、β两条链胞膜外结构均属于造血因子受体超家族(或称红细胞生成素受体超家族)成员。已证实GM-CSFRβ链为IL-3、IL-5受体所共用,但在人和小鼠β链的共同情况有所差异。
(1)小鼠GM-CSFR:α链又称STH分子,由包括信号肽在内的396个氨基酸组成,成熟分子约70kDa,与IL-3结合为低亲和力,Kd值4×10[SB]-8[/SB]M。小鼠GM-CSFr β链有AIC2A和AIC2B两种分子,其中AIC2A为GM-CSFR所特有,AIC2B则为GM-CSFR、IL-3R、IL-5R所共有。β链与GM-CSFRα链组成高亲和力受体,Kd为3×10[SB]-10[/SB]M。AIC2A由包括信号肽在内878个氨基酸组成,成熟分子120kDa,糖蛋白,胞浆部分413个氨基酸,不含激酶结构,但可被酪氨酸激酶磷酸化,在信号转导过程中发挥重要作用。
(2)人GM-CSFR:α链为低亲和力受体。人β链又称KH97分子,与小鼠GM-CSFr β链AIC2B有56%同源性,人GM-CSFR β链cDNA编码897个氨基酸,成熟分子120kDa,有16个氨基酸的先导序列,胞膜外区422个氨基酸,穿膜区26个氨基酸,胞浆区433个氨基酸,β链为IL-3、IL-5、GM-CSF受体所共用,其信号转导与酪氨酸磷酸化有关,有关信号转导机理参见本章第三节。
(3)GM-CSFR的分布:GM-CSFR主要分布于髓系细胞,但分布的方式有所不同。在中性粒细胞表面仅有GM-CSFR的α和β链,而无IL-5R和IL-3R的α链,因而IL-3、IL-5对GM-CSF与中性粒细胞表面GM-CSFR结合不发生竞争,由于α链数目少于或等于β链的数目,所以中性粒细胞表面仅有高亲和力GM-CSFR,而无低亲和力受体。IL-3、GM-CSF两种细胞因子均可作用于单核细胞,而且可以相互竞争结合。单核细胞可同时表达IL-3、GM-CSF的高亲和力受体,也表达这两种低亲和力受体,提示在单核细胞表面这两种细胞因子受体α链表达的数目多于β链。在嗜酸性粒细胞表面同时表达IL-3、IL-5和GM-CSF三种受体,而且IL-3、IL-5和GM-CSF三种配体均可相互竞争抑制。嗜碱性粒细胞亦具有这三种受体,但结合相应配体的能力依次是GM-CSF>IL-3>IL-5。
(三)G-CSF
1.G-CSF的产生 内毒素、TNF-α和IFN-γ可活化单核细胞和巨噬细胞产生粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)。此外,成纤维细胞、内皮细胞、星状细胞和骨髓基质细胞等在LPS、IL-1或TNF-α刺激活化后也可分泌G-CSF。某些白血病细胞以及CHu-2人口腔癌细胞、5637人膀胱癌细胞、MIAPa Ca-2胰腺癌细胞可组成性地表达G-CSF。
2.G-CSF的分子结构和基因 1986年G-CSF cDNA克隆成功,G-CSF基因全长2.5kb,包括5个外显子和4个内含子,人G-CSF基因位于17号染色体,与小鼠G-CSF基因约有73%同源性,与IL-6无论在基因水平以及氨基酸水平上都有很高同源性,包括外显子、内含子组成,Cys数目,两对二硫键位置以及分子的三级结构等。小鼠G-CSF分子共含有208个氨基酸,30个氨基酸先导序列,成熟蛋白为178个氨基酸。人类有两种不同的G-CSf cDNA,分别编码含207和204氨基酸的前体蛋白,均有30个氨基酸的先导序列,成熟蛋白分子分别为177和174个氨基酸,前者除了在成熟分子N端35位处插入了3个氨基酸外,其余的序列与174氨基酸分子相同。人G-CSF分子量为19.6kDa,PI6.1,O-糖基化,对酸碱(pH2~10)、热以及变性剂等相对较稳定。G-CSF有5个半胱氨酸,Cys 36与Cys42,Cys74与Cys64之间形成两对二硫健,Cys17为不配对半胱氨酸,二硫键对于维持G-CSF生物学功能是必须的因素。人和小鼠G-CSF在氨基酸水平有73%同源性,并具有相互交叉的生物学活性。
3.G-CSF受体 1990年G-CSF受体cDNA克隆成功,基因组16.5kb长,有17个外显子。G-CSFR为高亲和力受体,表达在造血祖细胞和中性粒细胞、胎盘细胞、内皮细胞和髓样白血病细胞株如HL-60细胞等,每个中性粒细胞有300~1000个G-CSFR,Kd为100pM。小鼠G-CSFR是高度糖基化的,含812个氨基酸。膜型G-CSFR包括胞膜外区、穿膜区和胞浆区。胞膜外区含有3个区域:(1)N端1个Ig样区;(2)1个红细胞生成素受体超家族结构域,这是识别G-CSF配体的部位;(3)三个串连的Ⅲ型纤维粘连素(fibronectin)结构区。人G-CSF R含813氨基酸,与小鼠G-CSFR有62%同源性。此外,人G-CSFR还有一种759氨基酸的异型(isoform),这种异型G-CSFR除C端序列不同外,其它部分与前者相同。G-CSFR还可以可溶性形式(sG-CSFR)存在于体液中。
4.G-CSF的生物学作用 G-CSF主要作用于中性粒细胞系(lineage)造血细胞的增殖、分化和活化。在体外G-CSF刺激骨髓造血祖细胞中中性粒细胞集落的形成,延长成熟中性粒细胞的存活时间,活化中性粒细胞,促进其ADCC,超氧阴离子的产生和碱性磷酸酶的合成。最近研究表明,单独G-CSF或与SCF协同可促进多能造血干细胞的增殖、干细胞母细胞集落形成以及体内CFU-S的形成。G-CSF还具有对人粒细胞、单核细胞、成纤维细胞、平滑肌细胞以及成肌纤维细胞的趋化作用。肿瘤患者注射G-CSF后可提高血循环中中性粒细胞的水平,这种作用可能与缩短某些骨髓细胞进入S期的时间以及增加生成粒细胞的祖细胞数量有关。
(四)M-CSF
巨噬细胞集落刺激因子(macrophagecolony stimulating factor,M-CSF)又称CSF-1,最初发现其存在于血清、尿或其它体液中,能刺激骨髓造血祖细胞巨噬细胞集落的形成。
1.M-CSF的产生 多种细胞均可产生M-CSF,包括:成纤维细胞、子宫内膜中分泌型上皮细胞、骨髓基质细胞、脑星状细胞、成骨细胞;LPS等激活的巨噬细胞、B细胞、T细胞和内皮细胞等;此外,多种肿瘤细胞如原粒细胞性白血病、淋巴母细胞性白血病、肺腺癌细胞、乳腺癌和卵巢癌等。
2.M-CSF分子的结构和基因 人和小鼠天然M-CSF为糖蛋白,由二硫键连接的同源双体,分子量40~90kDa。人M-CSF前体长度554~256个氨基酸不等,均有32个氨基酸的信号肽和23个氨基酸的穿膜部分。膜结合型M-CSF表达在单层培养的成纤维细胞,可刺激表达M-CSF受体的巨噬细胞的粘附和增殖。成熟M-CSF分子靠近N端150氨基酸在与M-CSF受体结合中起关键作用,人和小鼠M-CSF分子这个区域结构高度保守,其同源性达80%。
3.M-CSF受体 M-CSFR由c-fms原癌基因所编码。人和小鼠M-CSF和M-CSF受体基因分别定位于第5和第11对染色体,与GM-CSF、IL-3、IL-4、IL-5、IL-13和酸性FGF基因密切连锁。M-CSF受体为高亲和力,表达于循环的单核细胞和组织巨噬细胞以及胎盘滋养层细胞。人M-CSFR为穿膜糖蛋白,胞膜外区512个氨基酸,组成5个免疫球蛋白样区,穿膜区25个氨基酸,胞浆区435个氨基酸,并具有蛋白酪氨酸激酶区。通常M-CSFR是以同源二聚体形式存在。
4.M-CSF的生物学作用 M-CSF主要的生物学作用是促进单核-吞噬细胞包括破骨细胞在内的存活、增殖和活化。妊娠妇女尿中M-CSF水平明显增加,可能与胎盘的形成有关。M-CSF是炎症反应中的介质,并可提高巨噬细胞杀伤肿瘤细胞和微生物的能力。人M-CSF可作用于小鼠,而小鼠的M-CSF生物学作用则具有种属的特异性。
图4-3 细胞因子与造血细胞分化
合理应用重组人M-CSF有助于提高机体免疫应答水平,现已用于治疗某些肿瘤,提高化疗后总白细胞和粒细胞水平,还可治疗小儿慢性中性粒细胞减少症。
M-CSF可能与某些癌症、全身性红斑狼疮和骨质疏松症等疾病发生有关。白血病、淋巴细胞恶性增生、骨髓及外骨髓增殖性疾病、卵巢癌、子宫内膜癌、全身性红斑狼疮以及免疫性血小板减少性紫瘢病人血清或血浆中M-CSF的水平可升高。
(五)SCF
干细胞因子(stem cellfactor,SCF)又称肥大细胞生长因子(mast cell growth factor,MGF),最初是从Buffalo大鼠肝细胞系中cDNA克隆成功,在小鼠MGF基因位于第10号染色体SL基因,是C-kit的配体(C-kit ligand,KL),因此也称之造血生长因子KL。
1.SCF的产生 主要由肝细胞产生。
2.SCF的分子结构 人和小鼠SCF分别由248和220个氨基酸组成,约有80%同源性。SCF可以可溶性和膜结合两种形式存在,可能与SCf mRNA剪接或蛋白酶切割位点不同有关。在体内SCF以非共价相连同源二聚体形式存在,单体分子量约31kDa,单体中含有4个半胱氨酸残基,形成分子内二硫键。糖基对SCF生物学活性并非必需。
3.SCF受体 SCF受体即是C-kit,成熟SCF受体分子由953个氨基酸组成,其中胞膜外区497个氨基酸,属免疫球蛋白超家族成员,组成5个Ig样的结构域,与M-CSFR、PDGFR有较高的同源性;穿膜区由23个疏水性氨酸组成;胞浆区433个氨基酸,含有酪氨酸激酶和自身磷酸化的结构域。SCFR表达于多种干细胞、集落形成细胞和肥大细胞等。
4.SCF的生物学作用
(1)促进IL-3依赖的早期造血前体细胞的增殖和分化,可以IL-3、G-CSF、GM-CSF和EPO等细胞因子协同促进髓样、淋巴样和红细胞样细胞的产生。
(2)促进肥大细胞增殖。
(3)促进黑素母细胞(melanoblasts)的增殖。
SCF在骨髓移植、造血功能障碍以及干细胞基因治疗中有潜在的应用价值。目前SCF已进入临床Ⅰ期试验,主要治疗乳腺癌和淋巴瘤病人。
(六)EPO
红细胞生成素(erythropoietin,EPO)是一种刺激红细胞产生的糖蛋白。
1.EPO的产生
(1)肾脏是EPO产生的主要来源,产生EPO细胞为肾小管基底膜外侧的肾小管周围间质细胞(peritubular interstitial cell),由于这些细胞释放第Ⅷ因子,因此这种EPO产生细胞可能是一种肾小管周围毛细血管的内皮细胞。组织氧利用率下降所引起组织缺氧是诱导EPO产生的主要刺激因素。
(2)肝脏中枯否氏细胞
(3)骨髓中巨噬细胞
2.EPO的分子结构和基因 人和小鼠EPO基因分别定位于第7和第5号染色体。人EPO基因组为单拷贝,5.4kb长,有5个外显子和4个内含子。EPO基因上游有TATA盒,5′UTR处有AP-1、SP-1、NF-IL-6、GRE和NF-κB的结合序列。EPo cDNA编码193个氨基酸,包括27个氨基酸先导序列,成熟EPO分子由166个氨基酸组成,分子量为18kDa,在CHO细胞中表达rEPO为30kDa ,糖占39%,在人尿中的EPO为34kDa糖蛋白。
3.EPO受体 1989年从MEL细胞745表达文库中EPORcDNA克隆成功。人EPOR基因位于19号染色体,裸肽分子量为55kDa,糖基化后为66kDa,由508个氨基酸残基组成,包括24氨基酸残基的先导序列,成熟EPOR为484个氨基酸残基,其中,胞膜外区226,穿膜区22,胞浆区236个氨基酸残基,胞膜外结构属红细胞生成素/细胞因子受体超家族。还可能存在着66kDa与其它膜分子的复合物。EPOR有高亲和力和低亲和力两种,至今对EPOR组成的确切结构和信号转导还不清楚。目前至少已发现3种在自然状态下由于膜受体裂解脱落的可溶性EPO受体(sEPOR)。
4.EPO的生物学作用 EPO特异地作用于红细胞样前体,对其它细胞系几乎没有作用。EPO刺激骨髓中红细胞样前体细胞产生红细胞样集落形成单位(colony-formingunit-erthroid,CFU-E)和红细胞样爆发形成单位(burst-formingunit-erythroid,BFU-E)。CFU-E为迅速分裂的红细胞样前体细胞,对低浓度EPO即有反应;BFU-E则为更不成熟的红细胞样前体细胞,对EPO反应后,其分裂速度较慢。
EPO水平过高见于:(1)原发性红细胞增多症;(2)继发性红细胞增多症,如高原居住者,慢性阻塞性肺疾患,紫绀性心脏病,高亲和力血红蛋白病,吸烟,局限性肾脏缺氧,恶性或良性肾脏肿瘤,肝细胞瘤,肝癌,肾上腺肿瘤等。EPO水平过低主要见于肾功衰竭或晚期肾病引起的贫血,慢性感染、类风湿性关节炎、AIDS、肿瘤引起的贫血,其他原因引起的贫血等。患上述疾病机体可能产生IL-1、TNF-α,这些细胞因子是EPO活性的抑制剂。再生障碍性贫血、缺铁性贫血、地中海性贫血、巨幼细胞性贫血等病人EPO水平反而升高,表明上述贫血症原因并非由EPO缺乏所引起。
EPO主要用于肾功衰竭引起的贫血,还可用于类风湿性关节炎、多分性骨髓瘤、非Hodg-kin氏淋巴瘤、AIDS、化疗等原因引起的贫血。1989年美国FDA批准Amgen公司首先将rEPO投放市场。
(七)CSF的临床应用
如前所述,多种CSF已广泛应用于临床治疗多种疾病,体内应用CSF可提高循环血液中的血细胞,纠正贫血,减少感染等并发症,可明显改善症状,降低病死率。其主要适应症是下列原因引起的血液细胞减少(参见表4-15和表4-16)。
(1)肿瘤化疗引起的血液细胞减少;
(2)肿瘤放疗引起的血液细胞减少;
(4)再生障碍性贫血以及慢性肾衰、肿瘤及血引起的贫血;
(6)烧伤等。
三、肿瘤坏死因子
1975年Carswell等发现接种BCG的小鼠注射LPS后,血清中含有一种能杀伤某些肿瘤细胞或使体内肿瘤组织发生血坏死的因子,称为肿瘤坏死因子(tumor necrosis factor,TNF)。1985年Shalaby把巨噬细胞产生的TNF命名为TNF-α,把T淋巴细胞产生的淋巴毒素(lymphotoxin,LT)命名为TNF-β。TNF-α又称恶质素。
1.TNF的产生
(1)TNF-α是一种单核因子,主要由单核细胞和巨噬细胞产生,LPS是较强的刺激剂。IFN-γ、M-CSF、GM-CSF对单核细胞/巨噬细胞产生TNF-α有刺激作用,而PGE则有抑制作用。前单核细胞系U937、前髓细胞系HL-60在PMA刺激下可产生较高水平的TNF-α。T淋巴细胞、T细胞杂交瘤、T淋巴样细胞系以NK细胞等在PMA刺激下也可分泌TNF-α。SAC、PMA、抗IgM可刺激正常B细胞产生TNF-α。此外,中性粒细胞、LAK、星状细胞、内皮细胞、平滑肌细胞亦可产生TNF-α。
(2)TNF-β是一种淋巴因子,抗原和丝裂原均可刺激T淋巴细胞分泌TNF-β。PMA刺激RPMI1788B淋巴母细胞可分泌高水平TNF-β。
2.TNF的分子结构和基因
(1)人的TNF-α基因长约2.76kb,小鼠为2.78kb,结构非常相似,均由4个外显子和3个内含子组成,与MHC基因群密切连锁,分别定位于第6对和第17对染色体上。1984年从HL-60、U937等细胞中克隆成功rHuTNF-α cDNA,并在大肠杆菌中获得高表达。 人TNF-α前体由233个氨基酸残基组成,含76个氨基酸残基的信号肽,切除信号肽后成熟型TNF-α为157氨基酸残基,非糖基化,第69位和101位两个半胱氨酸形成分子内二硫键。rHu TNF-α分子量为17kDa。小鼠TNF-α前体为235氨基酸残基,信号肽79氨基酸残基,成熟的小鼠TNF-α(rMuTNF-α)分子量为17kDa,由156个氨基酸残基组成,第69位和100位两个半胱氨酸形成分子内二硫键,有一个糖基化点,但糖基化不影响其生物学功能。rHu TNF-α与rMu TNF-α有79%氨基酸组成同源性,TNF-α的生物学作用似无明显的种属特异性。最近有人报道通过基因工程技术表达了N端少2个氨基酸(Val、Arg)的155氨基酸人TNF-α,具有更好的生物学活性和抗肿瘤效应。此外,还有用基因工程方法,将TNF-α分子氨基端7个氨基酸残基缺失,再将8Pro、9Ser和10Asp改为8Arg、9Lys和10Arg,或者再同时将157Leu改为157Phe,改构后的TNF-α比天比天然TNF体外杀伤L929细胞的活性增加1000倍左右,在体内肿瘤出血坏死效应也明显增加。TNF-α和β发挥生物学效应的天然形式是同源的三聚体。
(2)人 和小鼠TNF-β基因分别定位于第6和第17号染色体。HuTNF-β分子由205个氨基酸残基组成,含34氨基酸残基的信号肽,成熟型Hu TNF-β分子为171个氨基酸残基,分子量25kDa。rHuTNF-β分子由202氨基酸残基组成,包括33个氨基酸残基的信号肽,成熟分子169个氨基酸残基,与Hu TNF-β有79%的同源性。Hu TNF-β与Hu TNF-αDNA同源序列达56%,氨基酸水平上同源性为36%。
3.TNF的受体
(1)TNF-R的分型:TNF-R可分为两型:Ⅰ型TNF-R,55kDa,CD120a,439氨基酸残基,此型受体可能在溶细胞活性上起主要作用;Ⅱ型TNF-R,75kDa CD120b,426氨基酸残基,此型受体可能与信号传递和T细胞增殖有关。两型TNF-R均包括胞膜外区、穿膜区和胞浆区三个部分,胞膜外区有28%的同源,但在有包浆区无同源性,可能与介导不同的信号转导途径有关。TNF-R属于神经生长因子受体(NGFR)超家族。TNF-α和TNF-β的受体可能是同一的。TNF-R存在于多种正常及肿瘤细胞表面,一般每个细胞受体数目有10[SB]3[/SB]~10[SB]4[/SB],如ME-180肿瘤细胞系TNF-αR约2000/个细胞,Kd为2*10[SB]-10[/SB]M。不同细胞表面TNF-αR的数目和亲和力似乎与细胞对TNF-α的敏感性并不平行。TNF-α与相应受体结合后信号传递的机理尚不清楚,可能与活化蛋白激酶C(PKC),催化受体蛋白磷酸化有关。
(2)可溶性TNFR:TNF结合蛋白(TNF-BP)是TNFR的可溶性形式,有sTNf RⅠ(TNF-BPI)和sTNFRⅡ(TNF-BPⅡ)两种。一般认为sTNFR具有局限TNF活性,或稳定TNF的作用,在细胞因子网络中有重要的调节作用。Seckiner 1988年发现发热患者尿中有TNF抑制物,分子量为33kDa。Olsson 1989年在慢性肾功不全患者血和尿中也发现有TNF-BP。TNF-BP可与TNF特异结合,抑制TNF活性,如抑制其细胞毒活性和诱导IL-1产生,可促进皮下接种Meth A肉毒的生长,可见于正常妊娠尿中。炎症、内毒素血症、脑膜炎双球菌感染、SLE、HIV感染、肾功不全时以及肿瘤时可升高。可溶性TNFR可有效地减轻佐剂性关节炎的病理改变以及败血症休克。
4.TNF的生物学活性 TNF-α与TNF-β的生物学作用极为相似,这可能与分子结构的相似性和受体的同一性有关。但有某些生物学作用方面也有不同之处。
(1)杀伤或抑制肿瘤细胞:TNF在体内、体外均能杀死某些肿瘤细胞(cytolytic action),或抑制增殖作用(cytostatic action)。肿瘤细胞株对TNF-α敏感性有很大的差异,TNF-α对极少数肿瘤细胞甚至有刺激作用。用放线菌素D、丝裂霉素C、放线菌酮等处理肿瘤细胞(如小鼠成纤维细胞株L929)可明显增强TNF-α杀伤肿瘤细胞活性。体内肿瘤对TNF-α的反应也有很大的差异,与其体外细胞株对TNF-α的敏感性并不平行。同一细胞系可能有敏感株和抵抗株如L929-S和L929-R。此外,靶细胞内源性TNF的表达可能会使细胞抵抗外源性TNF的细胞毒作用,因此,通过诱导或抑制内源性TNF的表达可改变细胞对外源性TNF的敏感性。巨噬细胞膜结合型TNF可能参与对靶细胞的杀伤作用。
TNF杀伤肿瘤的机理还不十分清楚,与补体或穿孔素(perforin)杀伤细胞相比,TNF杀伤细胞没有穿孔现象,而且杀伤过程相对比较缓慢。TNF杀伤肿瘤组织细胞可能与以下机理有关。
①直接杀伤或抑制作用:TNF与相应受体结合后向细胞内移,被靶细胞溶酶体摄取导致溶酶体稳定性降低,各种酶外泄,引起细胞溶解。也有认为TNFN激活磷脂酶A2,释放超氧化物而引起DNA断裂,磷脂酶A2抑制剂可降低TNF的抗病效应。TNF可或改变靶细胞糖代谢,使细胞内pH降低,导致细胞死亡。
②通过TNF对机体免疫功能的调节作用,促进T细胞及其它杀伤细胞对肿瘤细胞的杀伤。
③TNF作用于血管内皮细胞,损伤内皮细胞或导致血管功能紊乱,使血管损伤和血栓形成,造成肿瘤组织的局部血流阻断而发生出血、缺氧坏死。
(2)提高中性粒细胞的吞噬能力,增加过氧化物阴离子产生,增强ADCC功能,刺激细胞脱颗粒和分泌髓过氧化物酶。TNF预先与内皮细胞培养可使其增加MHCⅠ类抗原、ICAM-1的表达,IL-1、GM-CSF和IL-8的分泌,并促进中性粒细胞粘附到内皮细胞上,从而刺激机体局部炎症反应,TNF-α的这种诱导作用要比TNF-β为强。TNF刺激单核细胞和巨噬细胞分泌IL-1,并调节NHCⅡ类抗原的表达。
(3)抗感染:如抑制疟原虫生长,抑制病毒复制(如腺病毒Ⅱ型、疱疹病毒Ⅱ型),抑制病毒蛋白合成、病毒颗粒的产生和感染性,并可杀伤病毒感染细胞。TNF抗病毒机理不十分清楚。
(4)TNF是一种内源性热原质,引起发热,并诱导肝细胞急性期蛋白的合成。TNF引起发热可能是通过直接刺激下丘脑体温调节中枢和刺激巨噬细胞释放IL-1而引起,还可通过IL-1、TNF-α刺激其它细胞产生IL-6。
(5)促进髓样白血病细胞向巨噬细胞分化,如促进髓样白血病细胞ML-1、单核细胞白血病细胞U937、早幼粒白血病细胞HL60的分化,机理不清楚。TGF-β可抑制TNF-α多种生物学活性,但不抑制TNF-α对髓样白血病细胞分化的诱导作用,甚至还有协同效应。
(6)促进细胞增殖和分化:TNF促进T细胞NHCⅠ类抗原表达,增强IL-2依赖的胸腺细胞、T细胞增殖能力,促进IL-2、CSF和IFN-γ等淋巴因子产生,增强有丝分裂原或外来抗原刺激B细胞的增殖和Ig分泌。TNF-α对某些肿瘤细胞具有生长因子样作用,并协同EGF、PDGF和胰岛素的促增殖作用,促进EGF受体表达。TNF也可促进c-myc和c-fos等与细胞增殖密切相关原癌基因的表达,引起细胞周期由Go期向G1期转变。最近报道INF-β(LT)是EB病毒转化淋巴母细胞的自分泌生长因子,抗LT抗体、sTNf R以及TNF-α能抑制EB病毒转化淋巴细胞的增殖。
IL-1、IFN-γ和GM-CSF对TNF的生物学作用有明显的增强作用,可能与增加细胞TNF受体的表达有关。已报道一种抗TNF-α单克隆抗体,可模拟TNF-α的某些生物学作用,这种现象在其它因子中还尚未见到。
5.TNF与临床
应用TNF在治疗肿瘤等方面开始临床Ⅱ期试验,也可与IL-2联人事治疗肿瘤,目前认为全身用药的疗效不及局部用药,后者如病灶内注射,局部浓度高且副作用也较轻。近年来已采用TNF基因治疗开始对黑素瘤等肿瘤进行临床验证。值得重视的TNF又与临床某些疾病的发生有关。
TNF与IL-1和IL-6的生物学性质有许多相似之处(表4-8)。
表4-8 IL-1、IL-6和TNF的生物学性质比较
| 生物学性质 | IL-1 | TNF | IL-6 |
| 内源性热原质引起发热 | + | + | + |
| 肝急性期蛋白 | + | + | + |
| T细胞活化 | + | + | + |
| B细胞活化 | + | + | + |
| B细胞免疫球蛋白合成 | + | - | + |
| 成纤维细胞增殖 | + | + | - |
| 干细胞活化 | + | - | + |
| 非特异性抗感染 | + | + | + |
| 抗放射 | + | + | - |
| 滑膜细胞活化 | + | + | - |
| 内皮细胞活化 | + | + | - |
| 休克综合征 | + | + | - |
| 诱导IL-1、TNF、IL-6和IL-8 | + | + | - |
(1)感染性休克:目前认为革兰氏阴性杆菌或脑膜炎球菌引起的弥漫性血管内凝血、中毒性休克是由于细菌内毒素刺激机体产生过量TNF-α,引起发热,心脏、肾上腺严重损害,呼吸循环衰竭,甚至引起死亡,其TNF水平与病死率正相关。其发病机理可能是TNF刺激内皮细胞,导致炎症、组织损伤和凝血。TNF也是急性肝坏死的重要因素。病毒性暴发型肝衰竭外周血细胞诱生TNF,IL-1活性升高,且与病情程度相关。目前有关TNF介导内毒素性休克的机理还不很清楚。有认为TNF能促进前凝血酶原活性物质生成,抑制内皮细胞凝血酶调节毒素休克。TNF抗体(抗血清或单克隆抗体)在小鼠、家兔和狒狒体内均有效地阻止致死性内毒素体克的发生。应用抗TNf McAb治疗脓毒症和化脓性休克已进入Ⅲ期临床试验,抗TNF嵌合抗体治疗细菌性感染也已开始Ⅰ期临床试验。
(2)恶液质:TNF-α又称恶液素(cachectin),可诱发机体发生恶液质。
(3)TNF与病毒复制的关系:TNF还具有类似IFN抗病毒作用,阻止病毒早期蛋白质的合成,从而抑制病毒的复制,并与TNF-α和TNF-γ协同抗病毒作用。另一方面,TNF诱导HIV-Ⅰ基因在T细胞中表达。TNF和HIV感染的CD4+细胞中活化或诱导NF-κB,NF-κB结合于HIV的长末端重复序列(LTR)的增强子部位,活化HIV基因,可能与艾滋病发病有关。艾滋病患者单核细胞TNF-α产生增加,血清中TNF-α水平升高。
四、干扰素(IFN)
1957年Isaacs和Lindenmann首先发现了病毒干扰现象,即病毒感染的细胞能产生一种因子,作用于其他细胞干扰病毒的复制,因而命名为干扰素。目前已知干扰素并不能直接杀伤病毒,而是诱导宿主细胞产生数种酶,干扰病毒的基因转录或病毒蛋白组分的翻译。根据产生干扰素细胞来源不同、理化性质和生物学活性的差异,可分为α-干扰素(interferon α,IFN-α)、β-干扰素(interferon β,IFN-β)和γ-干扰素(interferon γ,IFN-γ)。
(一)IFN-α和IFN-β
IFN-α和IFN-β有许多相似之处,如:(1)两种IFN基因来自同一个祖先基因(common ancester gene);(2)由相同的细胞在相同的刺激物诱导下产生;(3)结合相同的受体,并发挥相似的生物学效应。
1.IFN-α/β的产生 IFN-α/β以往称为Ⅰ型IFN,主要由白细胞、成纤维细胞等在细菌、DNA或RNA病毒、多聚肌苷酸多聚胞苷酸(Poly I-C)、多核苷酸等刺激物诱导下产生。IFN-α/β在pH2或pH11以及热(56℃)条件下仍稳定,而IFN-γ则很易丧失活性。
2.IFN-α/β的分子结构和基因 IFN-α和IFN-β基因均位于人9号染色体和小鼠4号染色体,并连锁在一起。IFN-α基因至少有20个,成串排列在一个区域,无内含子,同一种属IFN-α不同基因产物其氨基酸同原性≥80%。人和小鼠IFN-β基因只有一个,无内含子,与IFN-α基因连锁在一起。IFN-β与IFN-α氨基酸组成有26~30%同源性。IFN-α由2个亚族(subfamily)组成,分别称为IFN-α1和IFN-α2,其中IFN-α1至少由20个有功能的基因组成,彼此间有90%左右的同源性;IFN-α2亚族有5~6个基因成员,目前只发现1个有功能的基因,其余是假基因。
IFN-α分子不同亚型由166/165个的氨基酸组成,无糖基,分子量约19kDa左右,不同种属之间同源性70%左右。IFN-α分子含有4个Cys1-99,Cys29-139之间形成两个分子内二硫键。IFN-α的生物学作用有一定的种属特异性。
人IFN-β分子含166个氨基酸,有糖基,分子量为23kDa,含有3个半胱氨酸,分别在17、31和141位氨基酸。31与141位半胱氨酸之间形成的分子内二硫键对于IFN-β生物学活性非常很重,141Cys被Tyr替代后则完全丧失抗病毒作用,而Cys17被Ser替代后不仅不影响生物学活性,反而是使IFN-β分子稳定性更好。糖基对生物学活性无影响。小鼠IFN-β分子只有一个Cys17,分子内无二硫键。IFN-β的生物学作用有较强的种属特异性。
3.IFN-α/β体受 一般认为,IFN-α和IFN-β结合相同的受体,IFT-α/βR基因定位于21号染色体,受体的亲和力Kd在10-9~10-10M之间,受体胞膜外结构属细胞因子受体中干扰素受体家族。IFN-α/β受体分布相当广泛,包括单核细胞、巨噬细胞、多形核白细胞、B细胞、T细胞、血小板、上皮细胞、内皮细胞和肿瘤细胞等。
4.IFN-α/β的生物学作用
(1)抗病毒作用:IFN-α/β具有广谱的抗病毒作用,其作用机理是:①通过抑制某些病毒的吸附(如VSV)、脱衣壳和最初的病毒核酸转录(如SV-40、HSV-1、流感病毒和VSV)、病毒蛋白合成(如SVS、SV-40)以及成熟病毒的释放(如逆转录病毒、HSV-1)等不同环节;②通过NK、巨噬细胞和CTL杀伤病毒感染靶细胞。
(2)抑制某些细胞的生长(cytostatic),如抑制成纤维细胞、上皮细胞、内皮细胞和造血细胞的增殖,其机理可能通过使细胞停留在Go/G1期,降低DNA合成,下调c-myc、c-fos等细胞原癌基因转录水平,下调某些生长因子受体表达,如EGf R、胰岛素-I R和M-CSFR等。
(3)免疫调节作用:促进大多数细胞MHCⅠ类抗原的表达,活化NK细胞和CTL。
(4)抑制和杀伤肿瘤细胞:IFN-α/β杀伤肿瘤细胞主要是通过促进机体免疫功能,提高巨噬细胞、NK和CTL的杀伤水平。
不同的INF-α亚型的诱生、抗病毒和免疫调节活性可有所不同,例如①同一病毒在不同细胞中诱生IFN-α亚型种类有很大差别,如仙台病毒在人白细胞中以诱生IFN-α1为主,其次为IFN-α2,少量IFN-α14;而在类淋巴母细胞中却以诱生IFN-α2为主,IFN-α1为次,无IFN-α14;在单核细胞中则主要诱导IFN-α8。②INF-α的不同亚型对于不同靶细胞表现出不同的抗病毒活性,如Hu IFN-α1在MDBK细胞上的抗病毒活性比Wish细胞高20~30倍,而HuIFN-α2a在这两种细胞中抗病毒活性无明显差别。③不同IFN-α亚型对不同病毒的抗病毒作用有很大差异,如HuIFN-α1抑制肾综合征出血热病毒的繁殖能力比IFN-α2a高15倍。④不同IFN-α亚型对MHC抗原表达、NK活性以及细胞因子产生的调节作用也有较大的差异,如Hu IFN-α1可促进单核细胞MHCⅡ类抗原的表达,而Hu IFN-α2则无这种诱导作用。
(二)IFN-γ
1965年Wheelock等首先在PHA刺激的白细胞培养上清中发现具有IFN样抗病毒物质,但在pH2条件下即失去抗病毒的活性。1973年Youngert和Salvin发现来自淋巴细胞培养上清中存在一种IFN,但抗原性不同于以往发现的IFN,遂命名为Ⅱ型IFN,1980年统一命名为IFN-γ。1981年Goeddle等将IFN-γ基因克隆成功。
1.IFN-γ的产生 主要由活化T细胞产生,在小鼠,由Th1亚群产生。当抗原、PHA或ConA刺激后T细胞分泌IFN-γ,通常与IL-2的产生相一致。目前认为巨噬细胞活化因子(MAF)的主要活性存在于IFN-γ中。此外,活化NK细胞也可产生IFN-γ。
2.IFN的分子结构和基因 人和小鼠IFN-γ基因分别定位于12号和10号染色体,在DNA水平上IFN-γ基因与IFN-α/β基因无同源性。人和小鼠IFN-γ在DNA水平上有65%左右同源性,在氨基酸水平的同源性只有40%左右。小鼠成熟IFN-γ分子由133个氨基酸残基组成。人IFN-γ成熟分子由143个氨基酸组成,糖蛋白,以同源双体形式存在,分子量为40kDa,其生物学作用有严格的种属特异性。
3.IFN-γ受体 人IFN-γR基因定位于第6号染色体,小鼠在第10号染色体。IFN-γ受体分布广泛,受体阳性细胞每个细胞约表达100~1000个受体,亲和力kD10-9~5*10-11M。裸肽分子量50kDa,糖基化后90kDa,其N末端与IFNα/β受体有一定的同源性,具有种属特异性。目前认为人IFN-γR可能存在着第二条链。
IFN-γR为穿膜糖蛋白,胞膜外区、穿膜外区、穿膜区和胞浆区分别有228、21和223个氨基酸残基,从胞膜外区结构特征来看,属于细胞因子受体干扰素受体家族,最近命名为CDw119。
IFN-γ配体诱导IFN-γR二聚体化在信号转导中可能起重要作用,并与受人本的磷酸化有关。IFN-γ与受体结合后可活化多种IFN-γ调节的基因。目前已知,IFN-γ刺激后至少有20种蛋白被表达,其中12种是IFN刺激后所特有的。这种表达是由于活化特异的DNA结合蛋白使其从胞浆移位到胞核,如干扰素刺激的基因因子2(interferon-stimulated gene fac-tor 2,ISGF2)和γ-干扰素激活因子(gamma-interferon activation factor,GAF或STAT91)结合到IFN基因启动子中两个称之为γ干扰素活化点(gamma-interferon activation site,GAS)和干扰素刺激的反应元件(interferon-stimulated response element,ISRE)的位置上。IFN-γ可促进HLA-B、HLA-DR、IP-10、P1激酶和2-5A合成酶的全成,其中P1激酶可抑制病毒蛋白的翻译,而2-5A合成酶则可裂解病毒RNA。
4.IFN-γ的生物学活性 IFN-γ生物学作用有较严格的种属特异性,人IFN-γ只作用于人或灵长类动物的细胞。
(1)诱导单核细胞、巨噬细胞、树突状细胞、皮肤成纤维细胞、血管内皮细胞、星状细胞等MHCⅡ类抗原的表达,使其参与抗原提呈和特异性免疫的识别过程。此外,IFN-γ可上调内皮细胞ICAM-1(CD54)表达,促进巨噬细胞FcγR表达,协同诱导TNF并促进巨噬细胞杀伤病原微生物。
(2)促进LPS体外刺激小鼠B细胞分泌和IgG2a,降低IgG1、IgG2b、IgG3和IgE的产生;抑制由IL-4诱导小鼠B细胞增殖,IgG1和IgE产生以及FcεRⅡ表达;促进SAC诱导的人B细胞的增殖。
(3)协同IL-2诱导LAK活性,促进T细胞IL-2R表达。
(4)诱导急性期蛋白合成,诱导髓样细胞分化。
(三)IFN的临床应用
IFN是第一个应用于临床的基因工程产品,目前IFN-α、IFN-β、IFN-γ都有基因工程产物,40多个国家使用干扰素制剂,治疗30多种疾病,但主要用于临床肿瘤、病毒性感染等治疗(表4-9)。
(1)治疗病毒性感染:IFN对慢性活动性乙型肝炎、慢性活动性丙型肝炎、单纯疱疹病毒性角膜炎、带状疱疹、慢性宫颈炎、新生儿巨细胞病毒性脑炎以及鼻病毒和冠状毒引起的普通感冒有一定疗效。
(2)抗肿瘤:IFN对多种肿瘤近期有良好疗效,如毛细胞白血病(hairy cell leukemia)、慢性髓样白血病、淋巴瘤、Kaposi氏肉瘤、黑素瘤、皮肤瘤、肾肉瘤、神经胶质瘤和骨髓瘤等。IFN抗肿瘤的机理是:①抑制肿瘤细胞增殖;②诱导NK、CTL等杀伤细胞,并协同IL-2增强LAK活性;③诱导肿瘤细胞表达NHCⅠ类抗原,增加对杀伤细胞的敏感性。
表4-9 干扰素治疗肿瘤、病毒性感染及其他疾病的疗效(1992)
| 疾 病 | 病 原 | 疗 效 |
| 肿瘤 | ||
| 毛细胞白血病 | 60%~90%缓解 | |
| 慢性白血病 | 50%部分缓解 | |
| 淋巴瘤 | 37%部分或完全缓解 | |
| Kaposi氏肉瘤 | 26%部分缓解 | |
| 急性白血病 | 24%部分缓解 | |
| 多发性骨髓瘤 | 20%部分或完全缓解 | |
| 神经胶质瘤 | 17%部分或完全缓解 | |
| 肾细胞癌 | 16%部分或完全缓解,较差 | |
| 恶性黑素细胞癌 | 10%以上部分或完全缓解,局部应用疗效较好 | |
| 卵巢癌 | 10%以上部分缓解(IFN-α腹腔注射) | |
| 乳腺癌 | 10%以上部分缓解,较差 | |
| 恶性胰腺肿瘤 | 部分改善 | |
| 星期直肠癌 | 部分改善 | |
| 食道癌 | 部分改善 | |
| 非小细胞性肺癌 | 部分改善 | |
| 小细胞性肺癌 | 部分改善 | |
| 病毒性感染 | ||
| 慢性活动性乙型肝炎 | VBV | 约40%患者HBe阴转,与激素联用可以提高疗效 |
| 丙型肝炎 | HCV | 约25%~50%患者ALT下降或 正常 |
| 艾滋病 | HIV | 抑制艾滋病患者HIV的复制,延长HIV带毒无症状者发病的潜伏期,缩小Koposi氏肉瘤,增加血清β2m水平,与AZT联合应用可以改善症状 |
| 唇和生殖器官复发性疱疹 | HSV-1,HSV-2 | 缩短病和程,减轻疼痛 |
| 带状疱疹 | VZV | 缩短病程,阻止扩散,减轻疼痛 |
| 肿瘤患者水痘 | VZV | 降低致命性的内脏合并症 |
| 病毒性角膜炎 | HSV-1,腺病毒 | 缩短病程,减少复发,痊愈率>90% |
| 红眼病 | 肠道病毒70 | 缩短病程 |
| 慢性宫颈炎(包括宫颈湿疣) | HPV,HSV,HCMV | 局部应用60%显效,95%有效 |
续表1
| 疾 病 | 病 原 | 疗 效 |
| 肛门-生殖器扁平湿疣 | HPV | 治愈率40~50% |
| 青年喉乳头状瘤 | HVP-11 | 肿瘤消失或缩小,但易复发 |
| 寻常疣 | HVP | 改善 |
| 巨细胞病毒 | HCMV | 尿毒症消失,降低发病率 |
| 普通感冒 | HRV | 缩短病程,痱毒减少 |
| 外阴前庭炎 | 50%与HPV有关 | 改善临床症状 |
| 呼吸道合胞病毒感染 | RSV | 志愿者试验表明,攻击前后均给药,可以明显减轻症状,但仅在病毒攻击后给药则无效 |
| 尖锐湿疣 | HPV | 疗效较好 |
| 其它疾病 | ||
| Behect氏病(征)(生殖器溃疡、口疮及眼色素层炎) | 不明 | γ干扰素治疗后,口、生殖器溃疡、结节性红斑、血栓性静脉炎、复发性关节炎等均可减轻症状或完合消除,但眼色素层炎、视神经乳头炎无改善,停药后易复发 |
| 类风湿性关节炎 | 不明 | γ干扰素治疗后疼痛明显减轻,40~50%缓解 |
| 慢性肉芽肿 | HFN-γ治疗有一定疗效 | |
| 多发性硬化症 | 不明 | 延长缓解期 |
| 精神分裂症 | 不明 | 部分改善 |
注:HBV hepatitisB virus,乙型肝炎病毒
HCV hepatitis C virus丙型肝炎病毒
HIV human immunodeficiency virus,人类免疫缺陷病毒
HSV herpes simplex virus,单纯疱疹病毒
VZV varicella-zoster virus,水痘-带状疱疹病毒
HPV human papilloma virus,人乳头状瘤病毒
HCMV human cytomegalouirus,人巨细胞病毒
HRV human rhinovirus,人鼻病毒
RSV respiratory syncytial virus,呼吸道合胞体病毒
IFN治疗一般无严重毒副反应,少数病例可有发热、疲劳不适、食欲不佳、白细胞减少以及血压波动等,停药后很快消失,IFN-a1b的副作用要明显低于IFN-a2a和a2b。重组IFN-a在治疗过程中有时可产生抗体,如发现抗体产生,应改用其他亚型的IFN-a。据报道,使用INF-a2a约有20.9%患者产生抗体,而使用IFN-a2b仅有6.9%使用者产生
五、转化生长因子-β(TGF-β)
转化生长因子-β(transforming growth factor-β,TGF-β)是属于一组新近发现的调节细胞生长和分化的TGF-β超家族。这一家族除TGF-β外,还有活化素(activins)、抑制素(inhibins)、缪勒氏管抑制质(Mullerian inhibitor substance,MIS)和骨形成蛋白(bonemorpho-genetic proteins,BMPs)。TGF-β的命名是根据这种细胞因子能使正常的成纤维细胞的表型发生转化,即在表皮生长因子(EGF)同时存在的条件下,改变成纤维细胞巾壁生长特性而获得在琼脂中生长的能力,并失去生长中密度信赖的抑制作用。TGF-β与早先报道的从非洲绿猴肾上皮细胞BSC-1所分泌的生长抑制因子是同一物。
1.TGF-β的产生
(1)机体多种细胞均可分泌非活性状态的TGF-β。在体外,非活性状态的TGF-β又称为latency associated peptide(LAP),通过酸外一时可被活化。在体内,酸性环境可存在于骨折附近和正在愈合的伤口。蛋白本科的裂解作用可使TGF-β复合体变为活化TGF-β。一般在细胞分化活跃的组织常含有较高水平的TGF-β,如成骨细胞、肾脏、骨髓和胎肝的造血细胞。TGF-β1在人血小板和哺乳动物骨中含量最高;TGF-β2在猪血小板和哺乳动物骨中含量最高;TGF-β3以间充质起源的细胞产生为主。
(2)活化后T细胞或B细胞产生TGF-β水平比静止细胞明显为高。
(3)几科所有肿瘤细胞内可检测到TGF-βmRNA。神经胶质细胞瘤在体内可分泌较高水平的TGF-β。
2.TGF-β的分子结构和基因 1985年TGF-β的基因克隆成功,并在大肠杆菌内得到表达。在哺乳动物至少发现有TGF-β1、TGF-β2、TGF-β3、TGF-β1β2四个亚型。在鸟类和两栖类动物还分别存在着TGF-β4和TGF-β5,对后两者的生物学作用所知甚少。
TGF-β是由两个结构相同或相近的、分子量的12.5kDa亚单位借二硫键连接的双体。人TGF-βcDNA序列研究表明,单体的TGF-β112氨基酸残基是由含400氨基酸残基的前体份子(per-pro-TGF-β)从羧基端裂解而来。pre-pro-TGF-βN端含有一个信号肽,在分泌前被裂解掉,成为非活性状态的多肽链前体(pro-TGF-β),通过改变离子强度、酸化或蛋白酶水解切除掉,成为非活性状态的多肽链前体(pro-TGF-β),通过改变离子强度、酸化或蛋白酶水解切除N端部分氨基酸残基,所剩余的羧基端部分形成有活性的TGF-β。TGF-β1与TGF-β2有71%氨基酸同源性,TGF-β1与TGF-β3有77%同源性,TGF-β2与TGF-β3有80%同源性。TGF-β与TGF-β超家族其化成员有30~40%同源性。
人TGF-β1、TGF-β2和TGF-β3的基因分别定位于染色体19q3、1q41和14q24,均含有7个外显子,核苷酸序列有高度同源性,所编码的前体分子C端者有9个保守的Cys,提示TGF-β1、TGF-β2和TGF-β3基因可能来自一个共同的祖先基因。人和小鼠TGF-β1的同源性高达99%,表明在不同种属中TGF-β都具有重要的生物学功能。对其人TGF-β1基因调控区进行了研究,发现该基因5`端序列包含5个明显的调控区:一个类增强子(enhancer-like)活性区,二个负调控区和二个启动子区。
3.TGF-β受体 许多细胞表面都有TGF-β受体。大鼠成纤维细胞系NRK-49F和BALB/c 3T3细胞表面TGF-β受体亲和力Kd值为5.6~14*10[SB]-1[/SB]1M,每个细胞TGF-β结合点约1.6~1.9*104。在淋巴细胞表面,TGF-βRKd值1~5.1*10-12M。T细胞、B细胞每个细胞TGF-βR数约250,活化后受体数量可增加5~6倍,但Kd值无明显变化。造血细胞表面TGF-βR对TGF-β1亲和力要比TGF-β2明显为高,这可能解释了造血细胞对TGF-β1反应要比TGF-β2更为敏感。TGF-β1、β2和β3结合细胞表面相同的受体。
最近发现TGF-βR存在着Ⅰ、Ⅱ、Ⅲ型三种形式,分子量分别为53kDa、70~85kDa和250~350kDa,。Ⅰ、Ⅱ型TGF-βR均为糖蛋白,它们和TGF-β1的亲和力要比和TGF-β2的亲和力大10~80倍;Ⅲ型受体是一种蛋白聚糖(proteoglycan),它与TGF-β1、TGF-β2、TGF-β3的亲和力近似,是为TGF-β主要的受体,可能在TGF-β发挥生物学功能中起着主要作用。TGF-βRⅢ又名Endoglin,CD105,TGF-β1和TGF-β3为其主要配体。
Ⅱ型TGF-βR胞浆区具有丝氨酸/苏氨酸激酶区。这种结构也见于活化受体Ⅱ(ActRⅡ)和ActRⅡB。Ⅲ型TGF-β受体本身缺乏蛋白激酶活性,对于其如何参与信号的传递还不清楚。当TGF-β诱导增殖时G蛋白可能参与诱导过程,此外,TGF-β促进Ca2+内流和胞内IP3水平的升高,激活PKC。
4.TGF-β的生物学作用 起初对TGF-β的生物学功能研究主要在炎症、组织修复和胚胎发育等方面,近年来发现TGF-β对细胞的生长、分化和免疫功能都有重要的调节作用。TGF-β1、β2和β3功能相似,一般来说,TGF-β对间充质起源的细胞超刺激作用,而对上皮或神经外胚层来源的细胞起抑制作用。
(1)抑制免疫活性细胞的增殖:①抑制IL-3、GM-CSF、M-CSF所诱导小鼠造血前体细胞和LTBMC的集落形成,并降低巨核细胞对IL-3T和CSF的反应性。②抑制ConA诱导或ConA与IL-2、IL-6联合诱导的胸腺细胞增殖。③抑制丝裂原、同种异体抗原刺激的T细胞增殖或IL-2依赖的T细胞生长。④抑制SAC刺激后IL-2依赖的B细胞增殖。
(2)对细胞表型的调节:①抑制IL-2诱导的T细胞IL-2R、TfR和TLiSA1活化抗原的表达,对CD3表达未见有影响。②抑制IFN-γ诱导黑素瘤细胞MHCⅡ类抗原表达。
(3)抑制淋巴细胞的分化:①抑制IL-2和BCDF依赖的B细胞分泌IgM,促进B细胞分泌Ig类型转换为IgA和IgE。②抑制混合淋巴细胞培养(MLC)中CTL、NK和LAK功能,这种抑制作用可被TNF-α(小鼠MIC)或IL-2(人MLC)所逆转。③抑制PBMC中NK活性以及NK细胞对TNF-α的的以应性。④抑制ConA和IL-2、IL-6协同诱导小鼠胸腺MHC非限制杀伤性细胞的活性。
(4)抑制细胞因子产生:如抑制PBMC中IFN-γ和TNF-α的产生。
(5)其它调节作用:①促进成纤维细胞、成骨细胞和雪旺氏细胞的生长。TGF-β1、TGF-β2促进人成纤维细胞IL-6的产生,其机理可能是通过对IL-6基因转录的调节。②抑制上皮细胞、破骨细胞、内皮细胞生长和脂肪、心肌、骨骼肌的形成。TGF-β可拮抗EGF的某些生物学功能。③促进细胞外基质(ECM)如胶原蛋白、纤粘连蛋白的表达和抑制ECM的降解,对细胞的形态发生、增殖和分化过程起着重要作用,有利于胚胎发育和细胞修复。动物体内实验表明,局部注射TGF-β可以促进伤口愈合和典型肉芽组织形成。④单核细胞和成纤维细胞的趋化剂,但不引起胶颗粒和氧化物的产生。⑤抑制淋巴细胞与内皮细胞的粘附。⑥促进嗜碱性粒细胞释放组织胺。
(6)TGF-β1与原癌基因表达:TGF-β1能诱导c-sis的表达,但抑制c-myc的表达,这种诱导或抑制作用与作用细胞种类及TGF-β的不同功能有关。如TGF-β诱导成纤维细胞中c-sis基因表达,与促进其在软琼脂中生长有关;而对上皮角朊细胞生长的抑制则与抑制c-myc基因表达有关。TGF-β1、TGF-β2和TGF-β3在大多数生物学作用方面非常相似,但在有些作用方面可有很大差异,如TGF-β2对血管内皮细胞和造血祖细胞的生长抑制作用仅为TGF-β1和TGF-β3的1%。
TGF-β在治疗伤口愈合,促进软骨和骨修复以及通过免疫抑制治疗自身免疫性疾病和移植排斥等方面有潜在的应用前景。
[α2-巨球蛋白的细胞因子载体效应]α2-巨球蛋白(α2M)是由4个相同多肽亚单位靠链同二硫键和非共价键结合形成具有交叉结构的四聚体。每个亚单位内由半胱氨酸的巯基与邻近的谷氨酰胺残基的羧基形成硫酸键。这种硫酯键易受蛋白水解酶裂解从而使α2M构型变化增加其电泳迁移率,称为快型α2M(Fα2M)硫酯键裂解可与含有巯基的细胞因子结合成复合物,出现细胞因子载体效应。
(1)IL-1β:IL-1β与α2M结合的最佳条件为pH9.0~9.3,这种结合是可逆的,与α2M结合的IL-1β呈“隐蔽”状态,如果IL-1β从复合物中释放出来,仍恢复自然的IL-1β活性。
(2)IL-6:α2M与IL-6结合可保护IL-6,不易被胰蛋白酶、糜蛋白酶以及组织蛋白酶G的作用,从而处长血浆中IL-6的半衰期。呈结合状态的IL-6并不改变基生物学活性。
(3)THF-β:α2M可降低血浆中THF-β的生物学活性,其机理除抑制THF-β与其相应受体结合外,α2M与THF-β复合物可能被具有α2M受体的吞噬细胞所清除。
(4)其它:α2M还可作为巨噬细胞活化因子(MAF)、血小板衍生的生长因子(PDGF)、碱性成纤维细胞生长因子(bFGF)的载体,对它们的生物学活性产生不同的影响。
胎牛血清中含有较高水平的α[XB]2[/XB]M,因此体外培养测定条件培养液中某引起细胞因子时应加注意。
表4-10 α[XB]2[/XB]M对所结合细胞因子活性的影响
| 所结合的细胞因子 | 细胞因子活性变化 | 影 响 机 理 |
| IL-1β | 部分降低 | 使IL-1β活性部位呈隐蔽状态 |
| IL-6 | 不 变 | 抑制多种酶裂解IL-6,从而延长IL-6在血浆中的半衰期 |
| TGF-β | 降 低 | 抑制TGF-β与相应受体结合,加速TGF-β的清除 |
| MAF | 不 变 | 保护作用 |
| PDGF | 降 低 | 加快PDGF的清除 |
| bFGF | 失 活 | 促进b-FGF的酶解,加速从血循环中排出 |
六、趋化因子
由组织细胞和微生物产生的趋化剂(chemoattractants)对白细胞的趋化作用(chemotaxis)是炎症发生过程中重要的起始步骤,也是机体防御和清除入侵病原体等异物先天性免疫功能的一个重要方面。1986年以前,“经典”的(classical)白细胞趋化物质主要有补体片段C5a、白三烯B4(leukotrinin B4,LTB4)、血小板激活因子(platelet-activating factor,PAF)和fMLP(N-formylmethionyl-leucyl-phenyl-alanine,N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸),这些趋化物质的受体同属于G蛋白偶联受体(Gprotein-coupled receptor)。
(一)趋化因子的种类
1.趋化因子的命名 1986年以来,陆续发一现了一类主要由免疫细胞产生的、具有趋化白细胞作用的细胞因子(chemoattractant cytokines或chemotacticcytokines)。在1992年第3届国际趋化因子研讨会上,绝大多数学者建议把chemoattractant(chemotactic)cytokine简称为chemokines,本书暂译名为趋化因子。趋化因子又称可诱导的小分子蛋白(small-inducible protein,SIP)、间分泌(intercrine)、细胞因子PE-4超家族(PF-4superfamily of common an-cestralcytokines)或PF-4样细胞因子(PF-4 likecytokine)等。
2.趋化因子亚族及其成员 通过基因克隆和cDNA、氨基酸序列分析,人的趋化因子超家族目前至少发现有19个成员,它们具有以下共同的特点。(1)来自同一个祖先基因(com-mon ancestral gene)。(2)成熟分子为分子量8~10kDa的小分子多肽。(3)可诱导性(inducible)。(4)不同成员在氨基酸水平上有21%~90%的同源性,其中不同亚族成员间同源性,其中不同亚族成员间同源性为21%~31%,同一亚族不同成员间同源性为25%~90%。所有趋化因子均含有4个Cys的保守基序(motif),组成特征性的两个二硫键。第一个Cys前的N端肽段较短,约4~12氨基酸,第4个Cys后C端肽段较长,为18~24氨基酸。(5)其相应的受体属于G蛋白偶联受体,这类受体有7个跨膜区(seven predicated transmembranedomains,STR),在胞浆内与三个亚单位所组成的G-蛋白(heterotrimeric G protein)相偶联。
根据多肽键一级结构中第1、2两上Cys排列的方式,可将趋化因子超家族分为两个亚族(subfamily):(1)C-X-C亚族(或α亚族),除NAP-4以外,这个亚族其余成员分子中N端两个Cys之间被另一个氨基酸残基所分隔;(2)C-C亚族(或β亚族),第1、2两个Cys是相连的。两个亚族所包括的成员见表4-11。
表4-11 两个趋化因子亚族所包括的成员
| C-X-C亚族(α亚族) |
| IL-8/NAP-1(interleukin-8/neutrophil-activating protein 1, 白细胞介素8/中性粒细胞激活蛋白1) |
| NAP2/CTAPⅢ/βTG(neutrophile-activating protein 2/connective tissue-activating peptide Ⅲ/β-thromboglobulin,中性粒细胞激活蛋白2/结缔组织激活肽Ⅲ/β-凝血球蛋白) |
| NAP-4(neutrophil-activating protein 4,中性粒细胞激活蛋白4) |
| GROα/NGSA(growth related gene α/melanoma growth-stimulating activity,生长相关基因α/黑素瘤生长刺激活性) |
| GROβ(growth related gene β,生长相关基因β) |
| GROγ(growth related gene α/melanoma growth-stimulating activity,生长相关基因α/黑素瘤生长刺激活性) |
| PF-4(platelet factor-4,血小板因子-4) |
| ENA-78(a 78-residue epithelial cell-derived neutrophil-activator,78氨基酸上皮细胞来源的中性粒细胞活化剂) |
| γIP-10(interferonγ-inducible protein-10,γ干扰素诱生蛋白-10) |
| Mig(monokine inducible by γ-interferon,γ干扰素诱生的单核因子) |
| GCP-2(granulocyte chemoattractant protein-1/monocyte chemotactic and activating factor,单核细胞趋化蛋白-1/单核细胞趋化和激活因子) |
续表1
| NCP-2/HC14(monocyte chemoatractant protein-2,单核细胞趋化蛋白-2) |
| MCP-3/NC28(monocyte chemoattractant protein-3,单核细胞趋化蛋白-3) |
| MIP-1α/LD78(macrophage inflammatory protein-1α,巨噬细胞炎症蛋白-1α) |
| MIP-1β/Act-2(macrophage inflammatory protein-1β,巨噬细胞炎症蛋白-1β) |
| RANTES(reduced upon activation,normal Texpressed and secreted,正常T细胞表达和分泌,活化时表达下降的因子) |
| 1309(活化人T细胞-种基因产物,cDNA克隆并表达成功) |
注:(1)NAP-2/CTAPⅢ/βTG是由血小板碱性蛋白(platelet basicprotein,PBP)N端加工后形成。
(2)LD78和Act-2分别是人的MIP-1α和NIP-1β,与小鼠源性MIP-1α和NIP-1β有很高同源性。
(3)GROα、GROβ和GROγ指基因产物。
3.趋化因子作用特点 趋化因子C-X-C和C-C亚族的生物学活性有明显的差别。C-X-C亚族中,除γIP-10、Nig和PF-4外,其余成员均具有趋化和激活中性粒细胞的活性。编码这个亚族成员的基因定位于第4号染色体长臂,氨基酸水平上的同源性在25%~90%。γIP-10主要趋化单核细胞和T细胞。C-C亚族主要趋化和激活单核细胞和某些T细胞亚群,基因定位于第17号染色体长臂,而且各成员的基因密切连锁,氨基酸水平上同源性在25%~70%。两个亚族之间同源性为21%~31%。
趋化因子除趋化和激活中性粒细胞、单核细胞或某些T细胞亚群外,有些成员还可趋化嗜酸性粒细胞,或趋化嗜碱性粒细胞并刺激其释放组织胺。某些趋化因子还具有刺激造血细胞、成纤维细胞、角化细胞或黑素瘤细胞的生长。趋化因子除了以游离形式发挥作用外,还可结合到细胞外基质(ECM)或内皮细胞表面,从而趋化白细胞到相应的组成或血管内皮处,聚集并激活中性粒细胞或单核细胞。下面仅就C-X-C亚族中的IL-8和GRO以及C-C亚族中MCP-1/MCAF、MIP-1α、MIP-1β和RANTES作一介绍。
(二)IL-8
1986年Kownatzki等首先证实了单核细胞可产生一种中性粒细胞趋化因子。嗣后,不同实验室根据这种因子不同的生物学活性有不同的命名,如中性粒细胞激活蛋白-1(neu-trophil-activating protein-1,NAP-1),单核细胞来源的中性粒细胞趋化因子(monocyte-derived neutrophil chemotactic factor,MDNCF),单核细胞来源的中性粒细胞激活肽(monocyte-derived neutrophil-activating peptide,MDNAP),中性粒细胞激活因子(neu-trophil-ac-tivating factor,NAF),中收粒细胞激活肽(neutrophil-activating peptide,NAP),T淋巴细胞趋化因子(t lymphocyte chemotactic factor,TCF)和内皮细胞来源的中性粒细胞激活肽(endothelial-derived neutrophil-activating peptide,EDNAP)。1988年基因克隆成功,属于C-X-C亚族(α亚族)成员,目前文献中多采用名称是IL-8(interleukin-8)/NAP-1。
1.IL-8的产生
(1)IL-1、TNF、LPS和PMA均能诱导单核细胞、巨噬细胞、内皮细胞、成纤维细胞和表皮细胞等合成分泌IL-8。
(2)PHA等丝裂原活的T细胞也可产生IL-8。
(3)人类多种肿瘤细胞均可高表达 IL-8。其中甲状腺癌、鳞状细胞癌、黑素瘤等可组成性产生IL-8,而星状细胞瘤、肝癌、肾细胞癌等则需要IL-1β或TNF-α等刺激下才合成和分泌IL-8。
2.IL-8的分子结构 IL-8分子量8.3kDa,不成熟的IL-8为99个氨基酸,单核细胞产生的成熟IL-8分子主要形式为72个氨基酸,而内皮细胞产生的成熟IL-8分子主要为77个氨基酸。在α亚族中,α与GROα、GROβ、GROγ、ENA-78和NAP-2相对有较高源性。IL-8分子含4个Cys,无N糖基化位上噗,IP8.0~8.5,耐热、耐碱,但对巯基化合物敏感。1988年Matsushima首次获得IL-8cDNA克隆,并在大肠杆菌和中国仓鼠卵母细胞中表达成功。人IL-8基因定位于第4号染色体,基因组有7个外显子和3个内含子。5`端上游有典型的“CAT”和“TATA”盒以及AP-1结合序列和糖皮质反应元件(GRE)等结构。IL-8基因与CXC亚族中PF-4、GROα、γIP-10基因相连锁成熟的IL-8分子的N端,是由蛋白酶水解的不同所致。在体外,凝血酶或血纤维蛋白溶酶可将77氨基酸形式裂解为72氨基酸形式的IL-8,后者较前者的生物学活性要高2~10倍。
3.IL-8受体 IL-8受体有两型:IL-8R A型(或IL-8RⅠ)和IL-8r B型(或IL-8RⅡ),两型受体在氨基酸水平上有77%同源性,最近命名为CDw128。IL-8rA特异性结合IL-8,为高亲和力,受体主要分布于中性粒细胞(每个细胞20000受体,Dd为8*10[SB]-10[/SB]M)、单核细胞、T细胞和黑素瘤细胞。IL-8B除IL-8结合外,还可结合GROβ、GROγ和NAP-2,与IL-8、GROα、GROβ和GROγ结合为高亲和力。与IL-8r B结合的这5种配体分子近N端均具有一个Glu-Leu-Arg(ELR)序列,可能是与IL-8r B结合的一个重要结构。此型受体主要分布于中性粒细胞和髓样细胞前体细胞系,如HL60细胞系。IL-8R属于G蛋白偶联受体,与fMLP受体和C5a受体有29%~34%同源性。IL-8与相应受体结合后可使细胞内Ca[SB]2+[/SB]浓度短暂升高,百日咳杆菌毒素(IAP)可抑制IL-8的这种刺激作用,表明IAP敏感的G蛋白与IL-8受体的信号转导有关。此外,细胞膜磷酸肌醇脂代谢和PKC也与IL-8R的信号转导有关。最近证实人红细胞膜表面Duffy抗原(gpD)可结合包括IL-8在内的多种趋化因子,这种受体还分布在肾脏和大脑,可能具有清除循环中IL-8等趋化因子的功能,在炎症发生过程中具有重要的调节作用。
4.IL-8的生物学活性
(1)趋化和激活中性粒细胞:IL-8的这种效应无明显种属特性。动物腹腔或静脉注射IL-8可引起外周血中性粒细胞数量的增加。IL-8可使中性粒细胞外形改变,促进其脱颗粒,激活中性粒细胞并使其产生呼吸爆发(respiratoryburst)、释放超氧化物(O2-、H2O2)和溶酶体酶。局部注射IL-8可趋化中性粒细胞,并刺激中性粒细胞产生白三烯B4(LTB4)而使皮下血浆渗出,IL-8还能诱导中性粒细胞上调Macl抗原(CD11b/CD18)的表达,促进中性粒细胞粘附到内皮细胞和内皮细胞下的基质蛋白。
(2)趋化嗜碱性粒细胞,并刺激其释放组织胺,可能与速发型超敏反应的发生有关。此外,还可刺激GM-CSF或IL-5预先处理的嗜酸性粒细胞的脱颗粒作用。
(3)趋化T淋巴细胞:可趋化部分静止的CD4+或CD8+T细胞,这种趋化作用需要单核细胞的同时存在。局部注射IL-8可使局部和引流区淋巴结T细胞明显增多。IL-8还可明显趋化IL-2活化和NK细胞。
(4)IL-8是角化细胞的复合促有丝分裂原(co-mitogen),也是黑素瘤细胞的自分泌生长因子。
5.IL-8与临床 目前关于IL-8与疾病的关系的研究仅仅开始。已发现牛皮癣皮屑中和类风湿性关节炎关节滑液中含有IL-8,IL-8可诱导中性粒细胞产生软骨降解酶,引起关节组织损伤,皮质激素能抑制非特异性炎症可能与抑制IL-8的产生有关。此外,某些与中性粒细胞积聚有关的炎症和呼吸系统疾病局部或血清中IL-8水平往往升高,如胃炎、炎症性结肠炎、肺纤维化或成人呼吸窘迫综合征、支气管肺泡灌洗液、慢性支气管炎、支气管扩张、败血症休克、急性脑膜炎球菌感染、酒精性肝炎等。IL-8水平升高往往与局部浸润的单核细胞和中性粒细胞数量相平行。
IL-8与 IL-1、TNF-α、G-CSF、GM-CSF或IFN等联合应用有可能治疗中性粒细胞减少症以及HIV所致的免疫缺陷症等。肿瘤局部注射IL-8可趋化中性粒细胞、T细胞和NK细胞,在治疗肿瘤中可能有应用前景。
(三)GRO
GRO(growth related gene,生长相关基因)可分为GROα、GROβ和GROγ三种,此处指基因产物,属于C-X-C亚族。GROα又称为黑素瘤生长刺激活性(melanoma growth-stimulating activity,MGSA),常以GROα/MGSA表示。GROα与GROβ和GROγ分别有90%和86%的同源性。GROα、GROβ和GROγ与ENA-78和NAP-2也有较高的同源性。此外,在DNA和氨基酸水平上人GRO与细胞因子诱导的大鼠中性粒细胞趋化剂(CINC)、小鼠巨噬细胞炎症蛋白-2(murinemacrophage inflammatory protein 2,MIP-2)也有较高的同源性。
GPOα前体长107氨基酸,切除N端34氨基酸先导序列后形成73氨基酸的成熟分子。单核细胞、成纤维细胞、黑素瘤细胞、上皮细胞和脐带静脉内皮细胞等经血清、PDGF或IL-1、TNF等炎症介质刺激下均可表达GPOα,在某些肿瘤细胞GPOα的表达是组成性的(con-stitutive)。GPOα趋化人中性粒细胞的能力约为IL-8的10倍,但在激活中性粒细胞并刺激其脱颗粒的作用则弱于IL-8。体内试验表明,GPOα与急性炎症的发生密切相关,使炎症局部有大量中性粒细胞浸润。GPOα对单核细胞则无趋化作用。GPOα对人Hs294T黑素瘤细胞的生长有一定的刺激活性,对滑膜来源的成纤维细胞Ⅰ型和Ⅲ型胶原蛋白的表达有下调作用。GPOα与IL-8RB有高亲和力的结合,还可与人红细胞膜Duffy抗原(gpD)结合。
(四)MCP-1/MCAF
单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)又称单核细胞趋化和激活因子(monoctye chemotactic and activating factor,MCAF),属于C-C亚族(β亚族)成员。MCP-1/MCAF起初是从人髓样单核细胞系THP-1、神经胶质瘤细胞系以及LPS或PHA刺激的人PBMC培养上清中发现。目前已知,单核细胞、巨噬细胞、成纤维细胞、内皮细胞、B细胞、平滑肌细胞等在PHA、LPS、Poly I-C、IL-1、IFN-γ、PDGF、EGF或某些病毒刺激下均可被诱导分泌MCP-1。某些肿瘤细胞系则可组成性产MCP-1。
人MCP-1/MCAF基因定位于第17对染色体。人MCP-1前体长99个氨基酸,切除23个氨基酸先导序列后形成76氨基酸的成熟分子,为碱性蛋白。非糖基化的MCP-1分子量8.7kDa,经不同糖基化后MCP-1分子量有13kDa两种。MCP-1分子中11与36Cys和12与52Cys之间所形成两个链内二硫键以及Try28和Arg30,对于MCP-1的生物学活性是必需的。在氨基酸水平上,MCP-1与另外两种单核细胞趋化蛋白MCP-2(HC14)和MCP-3(NC28)分别有62%和72%同源性,与C-X-C亚族中IL-8有24%同源性。
体内和体外实验均证实了MCP-1对单核细胞具有趋化活性,激活单核细胞和巨噬细胞,使其胞浆内Ca2+浓度升高,超氧阴离子的产生和释放,并释放溶菌酶,上调单核细胞和巨噬细胞粘附分子如integrin家族β2组和α4分子的表达和细胞因子IL-1、IL-6的产生,活化的巨噬细胞可抑制肿瘤细胞的生长。MCP是嗜碱性粒细胞的趋化剂和激活剂,尤其是刺激嗜碱性粒细胞脱颗粒和组胺释放的作用较为强烈。MCP-1与MCP-1R发生特异性的结合,此受体主要分布于单核细胞、髓样前体细胞系和嗜碱性粒细胞,属于IL-8R家族。分布于人红细胞表面的Duffy抗原也可结合MCP-1。
风湿性关节炎病人的滑液和血清中MCP-1水平明显升高,滑液组织巨噬细胞组成性地产生MCP-1,提示MCP-1与风湿性关节炎的病理损伤有关。高胆固醇血症时,动脉内侧平滑肌细胞产生高水平MCP-1,单核细胞粘附于血管壁并浸润动脉壁。肾脏炎症时,IL-1诱导肾小球细胞产生MCP-1。高血脂症时,LDL与肾小球细胞结合,刺激其产生MCP-1,趋化单核细胞在局部浸润。
(五)MIP-1α和MIP-1β
巨噬细胞炎症蛋白1(macrophage inflammatory protein 1,MIP-1)最初从LPS刺激小鼠巨噬细胞上清中发现。根据MIP-1分子结构的差异,可分为小鼠MIP-1α和MIP-1β,人的MIP-1α又称LD78,人的MIP-1β又称Act-2。在同一种属中,MIP-1α和MIP-1β间约有70%同源性。不同种属MIP-1之间也有较高的同源性,如人和小鼠MIP-1β有间约有70%同源性。不同和中属MIP-1之间也有较高的同源性,如人和小鼠MIP-1β有77%同源性,并且人和小鼠MIP-1α和MIP-1β均有种属交叉反应性。成熟的人和小鼠MIP-1β分子均为69个氨基酸,MIP属于C-C亚族(β亚族)的成员。
表4-12 MIP-1α和MIP-1β生和的学活性比较
| 生物学活性 | MIP-1α | MIP-1β[SB](a)[/SB] |
| 趋化单核细胞 | + | + |
| 趋化嗜酸性粒细胞并刺激其脱颗粒 | + | |
| 趋化嗜碱性粒细胞 | + | - |
| 刺激肥大细胞、嗜碱性粒细胞释放组织胺 | + | |
| 趋化T细胞 | CD4+、CTL | “naive”T |
| 趋化B细胞 | + | |
| 急性炎症性肉芽肿介质 | [SB]+[/SB] | |
| 保进CD8+T细胞与内皮细胞的粘附[SB](b)[/SB] | ± | + |
注:(a)MIP-1β对某些生物学功能的调节作用尚未见有报道。
(b)T细胞需MIP-1预处理;内皮细胞需经MIP-1等因子的刺激,使之表达VCAM-1分子。
活化后的T细胞、B细胞、单核细胞和肥大细胞均表达MIP-1α和MIP-1β。MIP-1α和MIP-1β均可趋化单核细胞,但对其它细胞的调节作用则有所差别(表4-14)。
MIP-1α与MIP-1α/RANTES受体结合,MIP-1α/RANTES受体正如命名所示,除与MIP-1α配体结合外,还可与RANTES结合,此型受体主要分布于单核细胞、T细胞、髓样细胞前体细胞系、B细胞以及嗜酸性粒细胞和嗜碱性粒细胞等。
(六)RANTES
RANTES是reduced upon activation,nornal T cell expressed andsecreted的略写词,国内尚未见翻译的专业术语,从产生条件角度一为试译,似为此种趋化因子在正常T细胞表达和分泌,活化时其产生水平则降低。RANTES最初认为是只是T细胞产生的,以后发现,RANTES与凝血酶刺激人血小板所释放的嗜酸性粒细胞趋化物质是同一种分子。除T细胞(CD4+和CD8+)和血小板外,肾小和官上皮细胞、肾小球膜细胞、肾脏、肝脏等也可表达RANTES。人RANTES的前体是高度碱性的蛋白,91个氨基酸,切除23个氨基酸先导序列后成熟分子含68氨基酸,与MIP-1α和MIP-1β有较高同源性。作小鼠RANTES在氨基酸水平上同源性有90%以上。RANTES属于C-C亚族(β亚族)成员。
RANTES对多种白细胞具有趋化或/和刺激作用:(1)趋化单核细胞;(2)趋化未刺激的CD4+CD45RO+记忆T细胞以及活化后的CD4+和CD8+T细胞;(3)趋化嗜酸性粒细胞并刺激其脱颗粒和呼吸爆发;(4)是嗜碱性粒细胞较强的趋化剂,但刺激其组织胺等介质释放的作用较弱;(5)RANTES预外理T细胞可增加其与IL-1α刺激内皮细胞的粘附能力。
百日咳杆菌外毒素可抑制RANTES的生和的学活性,提示其受体跨膜信号的转导与IL-8R相似。RANTES与MIP-1α/RANTES受体相结合,些型受体主要分布于单核细胞、T细胞、髓样细胞前体细胞系、B细胞、嗜酸性粒细胞和嗜碱性粒细胞等,如人单核细胞性白血病细胞系THP-1上与MIP-1α/RANTES结合位点每个细胞约700个,Kd值700pM。
七、其它细胞因子
(一)LIF
60年代末人们就发现一种能诱导M1白血病细胞系分化为正常细胞的因子,后称之为白血病抑制因子(leukemia inhibitory factor,LIF)。小鼠和LIF cDNA分别于1987年和1988年克隆成功。
1.LIF的产生 已在活化的T细胞、单核细胞、神经胶质细胞、肝成纤维细胞、骨髓基质细胞、胚胎干细胞、胸腺上皮细胞等多种细胞中发现有LIF的表达。
2.LIF的分子结构和基因 人和小鼠LIF基因分别定位于第22号和第11号染色体,基因长度分别人6.0kb和6.3kb,均含有3个外显子和2个内含子,基因编码区域具有高度的保守序列,其同源性在78~94%。ILF为180个氨基酸,核心蛋白分子量为20kDa,有7个糖基化位点,6个Cys,分子内部二硫键对于维持LIF分子的结构和生物学活性可能起重要作用。由于糖基化程度的不同,LIF分子量和电荷有所差别,分子量38~64kDa,IP8.6~9.2。LIF体外生物学功能似乎与糖基化程度无关,但糖基化是否影响LIF在体内稳定性和功能尚待确定。人和小鼠LIF在氨基酸水平上有78%同源性,人LIF对鼠源性细胞有相似的活性,而小鼠LIF对人的细胞则作用很弱。在氨基酸水平上,LIF与抑瘤素-M(oncostatin M,OSM)和睫状神经营养因子(CNTF)有一事实上的同源性,而且在蛋白质分子二级结构上也有相似之处。
3.LIF的受体 ILF受体α链为低亲和力受体,其结构属于红细胞生成素受体家族成员,含有2个该家族特征性结构域。gp130是LIF受体的另一个亚单位,与LIF受体α链共同组成高亲和力受体。LIF受体分布较广泛,如脂肪细胞、成骨细胞、神经细胞、胚胎癌细胞、胚胎干细胞、M1白血病细胞以及活化的巨噬细胞等。
4.LIF的生物学活性
(1)调节细胞的增殖、分化和表型:LIF抑制小鼠胚胎干细胞(embryonic stem cell,ES)的分化。对于造血系统中的肿瘤细胞,LIF常显示出抑制效应,同时诱导这些肿瘤细胞的分化,例如LIF可抑制小鼠白血病M1细胞的增殖,诱导其转变为巨噬细胞表型,如表达Fc受体,并获得吞噬能力等。对单核细胞的分化也超诱导作用。LIF与GM-CSF、G-CSF或IL-6协同抑制HL-60和U937细胞的生长,并诱导其分化。LIF增强IL-3对巨核细胞前体的造血干细胞的致有丝分裂作用,提高体内巨核细胞和血小板的数量。LIF还可促进成肌细胞的增殖。在一定条件下,LIF可促进新生大鼠背根神经节中的神经元表型从肾上腺素能型转变为胆碱能型,因此LIF又称为胆硷能神经元分化因子(cholinergic neuronaldifferentia-tion factor,CNF)。此外,LIF还可促进移植神经嵴分化的胚胎性神经元的存活。
(2)抑制脂蛋白脂酶活性,降低3T3-L1脂肪细胞对游离脂肪酸的摄取。
(3)促进骨的重吸收,这种作用可能是通过LIF刺激成骨细胞合成前列腺素所介导的。
(4)诱导肝脏急性期蛋白的产生。
(二)OSM
1.OSM的产生 1986年Zarling等首次从PMA活化U937细胞培养上清中分离纯化到一种因子,这种因子有明显抑制A375人黑素瘤细胞生长而命名为抑瘤素-M(oncostatin M,OSM)。以后从PHA活化的T细胞、单核细胞或HTLV-Ⅱ感染的人T细胞培养上清中也发现OSM。
2.OSM的分子结构和基因 人OSM基因定位于22号染色体,基因组由3个外显子和2个内含子组成,与LIF基因结构相似。OSM前体有252个氨基酸,切除25个氨基酸的先导序列后称之原OSM,含227个氨基酸,在类胰蛋酶作用位点(RSRR)切除原OSm C端31个氨基酸后,形成196个氨基酸成熟分子,含有N-和O-糖基化位点,为28kDa糖蛋白。OSM分子中有5个Cys,Cys31-Cys152和Cys74-Cys192形成两个分子内二硫键,其中Cys74-Cys192二硫键对于维持OSM生物学活性非常重要。OSM对热和酸稳定。OSM与LIF、G-CSF、IL-6及CNTF分子之间有一定的同源性和相似的二级结构。
3.OSM的受体 gp130是OSM受体的一个亚单位,是识别OSM的低亲和力受体,在组成OSM高亲和力受体中,除gp130亚单位外,还有LIFR的参与。此外,另一个特异性的组成高亲和力受体的亚单位(OSMR)还有待证实。OSM受体广泛分布于多种肿瘤细胞、内皮细胞和上皮细胞。
4.OSM的生物学活性
(1)调节细胞的生长和分化:这方面的活性与LIF相似。OSM可抑制多种肿瘤细胞的生长,如低剂量OSM即可抑制大多数肺癌及乳腺癌细胞的生长。诱导某些肿瘤细胞的分化,如诱导小鼠髓样白血病细胞系M1分化为巨噬细胞样细胞,协同GM-CSF促进人U937细胞的分化。抑制骨髓干细胞的分化。促进Kaposi氏肉瘤的生长并分泌IL-6。诱导多种成纤维细胞和人红白血病细胞株TF-1的增殖。
(2)诱导肝癌HepG2细胞等产生急性期蛋白,增加LDL受体,增加肝脏对胆固醇的摄取。
细胞因子种类繁多,作用复杂,新的细胞因子不断涌现。除前述的细胞因子外,还有核糖核酸酶超家族中血管生成素,表皮生长因子家族中表皮生长因子、转化生长因子-α、肝素结合EGF样生长因子,成纤维细胞生长因子家族的碱性成纤维细胞生长因了和酸性成纤维细胞胞生长因子,胰岛素样生长因子家族中胰钪素样生长因子,血小板衍生的生长因子家族中血小板衍生的生长因子和血管内皮细胞生长因子,以及肝细胞生长因子、神经生长因子和多效素等,现归纳为“部分细胞因子-览表”供参考。
表4-13 部分细胞因子-览表
| 细胞因子 | 细胞因子 | 分子组成 | 来 源 | 受 体 | 功 能 |
| 家族归类 | |||||
| 血管生成素(angiogenin,ANG) | 核糖核酸酶超家族 | 单链13aa(14.2kDa) | HT-29人腺癌细胞、WI-38成纤维细胞、外周血淋巴细胞、正常克隆上皮细胞、A549人肺癌细胞 | 肌动蛋白 | (1)与TGF-β、aFGF、bFGF有协同作用 (2)结合ECM,支持内皮或成纤维细胞的粘附和移动,有新生血管作用 (3)引起细胞表面肌动蛋白的聚合和释放 |
| 表皮生长因子(epidermal growth factor,EGF) (又名尿抑胃素,urogastrone) | 表皮生长因子家族 | 1.膜结合形式发挥近分泌作用(juxta-crine)2.可溶性形式53aa(6kDa) | 1.存在于众多体液和汗腺 2.在血小板中有EGF样活性 | EGFR170kDa有PTK结构 | (1)促进间质及上皮细胞增殖和分化 (2)促进成纤维细胞和内皮细胞增殖 (3)在体内介导上皮生长,促进血管形成,抑制胃酸分泌(4)加速伤口愈合 |
| 转化生长因子-α(transforming growth factor,-α,TGF-α) | 表皮生长因子家族 | 1.膜结合形式 2.可溶性形式50aa(6kDa) | 垂体、脑、皮肤角化细胞、巨噬细胞 | EGFR | (1)正常和异常细胞的分化 (2)促进成纤维细胞和上皮的生长(3)体内的血管生成因子和角化细胞游走刺激物 |
| 肝素结合EGF样生长因子 (heparin-binding EGF-like growth factor,HB-EGF) | 表皮生长因子家族 | 1.膜结合形式 2.可溶性形式 86aa | 肺、骨骼肌、脑、心脏、创伤部位 | EGFR | 促进成纤维细胞和平滑肌细胞的增殖 |
续表1
| 细胞因子 | 细胞因子 | 分子组成 | 来 源 | 受 体 | 功 能 |
| 家族归类 | |||||
| 成纤维细胞生长因子(fibroblast growth factor,FGF) | 成纤维细胞生长因子于家族 | 碱性FGF 155,157,163aa (18~kDa)酸性FGF 155aa (16~18kDa) | 碱性FGF;神经组织、垂体、肾上腺皮质、黄体和胎盘酸性FGF:脑、视网膜、骨基璺和骨肉瘤 | FGFR1 FGFR2 FGFR3 FGFR4 | (1)刺激所有中胚层来源的细胞,以及许多神经外胚层、外胚层和内胚层来源的细胞的增殖(2)体内对内皮细胞有趋化和促有丝分裂作用,促进血管形成(3)碱性FGF介导神经元的分化、存活和再生,刺激神经胶质细胞的移行 (4)参与由细胞过度增殖和血管过度形成所引起的多种病理损害 |
| 肝细胞生长因子 (hepatocyte growth factor,HGF) | (与其它细胞因子无相似性) | 又链α44aa β234aa 674aa (82kDa) | 枯否氏细胞/巨噬细胞、内皮细胞、胚胎肺成纤维细胞、Ito或肝脂肪贮存细胞、血管平滑肌 | c-mot原癌基因产物 | (1)促进各种上皮及中胚层和外胚层来源的细胞的增殖 (2)对上皮和内皮细胞有促游走作用 (3)参与最初的形态发生(4)抑制人燕麦细胞癌、HcpG2肝细胞癌、B6/F1黑素细胞和KB鳞状细胞癌的生长 |
| 胰岛素样生长因子(insulin-like growth factor,IGF) | 胰岛素样生长因子家族 | IGF-Ⅰ单单链,70aa IGF-Ⅱ单链,67aa | 肝脏等多种组织 | IGF-ⅠR IGF-ⅡR | (1)参与神经组织的生长和维持 (2)IGF-Ⅱ是胎儿生长发育和成人胸腺组织中主要的IGF |
| 神经生长因子 (never growth factor,NGF) | (与其它细胞因子无相似性) | 同源双体单链,120aa(26kDa) | (鼠)下颌下管上皮、神经元、雪旺氏细胞成纤维细胞、平滑肌细胞、甲状腺滤泡旁细胞 | p140[SB]TRK[/SB](TRK原癌基因产物);p75[SB]LNGFR[/SB] | (1)维持感觉、交感神经元的存活(2)趋化中性粒细胞和提高其存活和吞噬水平,诱导单核细胞分化 |
| 血小板衍生的生长因子(platclet-derived factor,PDGF) | 血小板衍生的生长因子家族 | 同源或异源双体A:125或110aaB:160或109aa | 动脉内皮细胞、激活的单核/巨噬细胞、新生鼠动脉平滑肌细胞、刺激的成纤维细胞、细胞滋养层及多种肿 | PDGF-Rα PDGF-Rβ | (1)促进皮肤成纤维细胞、神经胶质细胞、平滑肌细胞、上皮及内皮细胞的增殖(2)趋化成纤维细胞、平滑肌细胞、中性粒细胞和单个核细胞 |
续表2
| 细胞因子 | 细胞因子 | 分子组成 | 来 源 | 受 体 | 功 能 |
| 家族归类 | |||||
| 瘤细胞 | (3)抑制NK细胞的活性 (4)刺激中性粒细胞、单核细胞释放颗粒及中性粒细胞的吞噬作用 (5)刺激胶原蛋白的合成 (6)调节血栓海绵蛋白的表达和分泌(7)刺激胶原酶的活性和分泌 (8)调节神经再生 、神经胶质细胞增殖和分化 | ||||
| 血管内皮细胞生长因子 (vascular endothelial growth factor,VEGF) | 血小板衍生的生长因子家族 | 同源双体 121aa 165aa 188aa 206aa (34~42kDa) | 大多数肿瘤细胞、伤口中角化细胞和巨噬细胞 | Flt KDR | (1)体内重要的和因管生成因子之一,促进内皮细胞的有丝分裂和对蛋白质及其它分子通透性的升高,刺激单核细胞移行穿过内皮细胞层 (2)在实体瘤和伤口愈合中发挥促有丝分裂和提高通透性 |
| 多效素(pleiotrophin,PTN) | (与其它细胞因子无相似性) | 136aa (18kDa) | 成骨细胞、软骨细胞、成纤维细胞、星形胶质细胞、少突胶质细胞、雪旺氏细胞、神经元、垂体后叶细胞、睪丸间质细胞、基质层角化细胞、肿瘤细胞 | PTNR | (1)刺激轴突的生出和神经元的分化 (2)与肿瘤的发生有关 |
八、细胞因子的临床应用
目前,细胞因子已广泛应用于临床多种疾病的治疗,其中以干扰素、各种集落刺激因子最为常用。部分细胞因子已获美国FDA批准投放市场,有的细胞因子已进行不同阶段的临床试验或正在申请获准准投放市场。有关细胞因子临床应用的情况参见表4-14和表4-15。
表4-14 美国FDA批准投放市场的重组细胞因子
细胞因子 商品名 公 司 名 适 应 症 FDA批准日期 IFN-α2a Roferon-A Hoffmann-La Roche 毛细胞性白血病 1986.6 艾滋病相关的Kaposi氏肉瘤 1988.11 INF-α2b IntronA Schering-Plough 毛细胞性白血病 1986.6 生殖器疣 1988.6 艾滋病相关的Kaposi氏肉瘤 1988.11 非甲非乙肝炎(丙型肝炎) 1991.2 IFNαn3 Alferon A Interferon Sciences 生殖器疣 1989.10 IFN-γ1b Actimmune Genentech 慢性肉芽肿 1989.10 α-EPO Eopgen Amgen 慢性肾功衰竭合并贫血, 1989.6 AZT 治疗HIV感染的贫血 PROCRIT Ortho Biotech 同上 1990.12 G-CSF Neupogen Amgen 化疗后中性粒细胞减少症 1991.2 filgrastim GM-CSF Prokine Hoechst-Roussel 自身骨髓移植 1991.3 Sargramostim Leukine Immunex 自身骨髓移植 1991.3 Sargramostim
表4-15 美国尚未投入市场的重组细胞因子开发状况(1991 年)
细胞因子 商品名 公司名 适应症 开发现状 IL-1α Immunex 预防化疗和放疗所致的骨髓 Ⅰ/Ⅱ期临床 抑制,肿瘤 IL-1β Immunex 预防化疗和放疗所致的骨髓 Ⅰ/Ⅱ期临床 Syntex 抑制,肿瘤 Immunex 伤口愈合 Ⅱ期临床 IL-2 Amgen 肿瘤 Ⅲ期临床 Hoffmann-La Roche 与IFN-α联合用于肿瘤治疗 期临床 Proleukine Cetus 肾细胞癌 已申请 aldesleukin 肿瘤 Ⅰ/Ⅲ期临床 Cetus 与AZT联合治疗Kaposi氏肉瘤 Ⅰ期临床 PEG-IL-2 与AZT联合治疗AIDS Ⅰ期临床 IL-3 Hoechst-Roussel 骨髓功能衰竭、血小板减少 Ⅰ/Ⅱ期临床 自身骨髓移植、化疗佐剂
续表1
细胞因子 商品名 公司名 适应症 开发现状 Immunex 外周干细胞移植 Ⅰ期临床 IL-4 Schering-Plough 免疫缺陷病、肿瘤、疫苗佐剂 Ⅰ/Ⅱ期临床 Sterling Drug 肿瘤 Ⅱ期临床 G-CSF Neupogen Amgen 艾滋病、白血病、再生障碍性贫血 已申请 filgrastim 贫血 M-CSF Macrolin Cetus 肿瘤、真菌病 Ⅰ期临床 Genetics Institute 肿瘤、白血病、骨髓移植 Ⅰ期临床 GM-CSF Leukine Immunex 同种骨髓移植,化疗佐剂 Ⅲ期临床 Sargramostim 艾滋病 Ⅱ期临床 Prokine Hoechst-Roussel 再次化疗所致中性粒细胞减少 Ⅲ期临床 sargramostin Amgen 化疗佐剂 Ⅰ/Ⅱ期临床 Leucomax Sazdoz 血细胞减少 已申请 Schering-Plough 血细胞减少 已申请 Genetics Institute 血细胞减少 正申请 αEPO PROCRIT Ortho Biotech 肿瘤或肿瘤化疗所致贫血 Ⅲ期临床 防止手术失血所致贫血 Genetics Institute 自体输血佐剂 βEPO Marcogen 肾病继发贫血 已申请 Sterile Chugai-Upjohn 自体输血,取代输血 Ⅱ/Ⅲ期临床 SCF Amgen 乳腺癌和淋巴瘤 Ⅰ期临床 IFN-α2a Roferon A Hoffmann-La Roche 与5-氟尿嘧啶联合治疗直肠癌,乙型肝炎、非甲非乙肝炎、慢性髓性白血病、胃癌,与AZT联合治疗HIV阳性、ARC和艾滋病 Ⅱ期临床 IL-α2b Intron A Schering-Ploough 浅表膀胱癌、基底细胞癌、慢性乙肝炎、丁型肝炎、丙型肝炎 已申请 ` 丙型肝炎 急性乙型肝炎、慢性髓样 Ⅲ期临床 白血病 与AZT联合治疗HIV感染 Ⅰ期临床 IFN-αn3 Alferon LDO Interferon Sciences ARC、爱滋病 Ⅰ/Ⅱ期临床 IFN-β R-Prone Serono Sciences 肿瘤 Ⅰ期临床 Belaseron Berlex Lab. 多发性硬化症 Ⅲ期临床 肿瘤 Ⅰ/Ⅱ期临床 IFN-γIL Actimmune Genentech 小细胞肺癌、特应性皮炎 Ⅲ期临床 肾细胞癌、外伤感染 Ⅱ期临床 哮喘和过敏 Ⅰ期临床 Immuneron Biogen 类风湿性关节炎 Ⅰ/Ⅲ期临床 生殖器疣 Ⅱ期临床 TNF Amgen 肿瘤、传染病 Ⅱ期临床 Biogen 肿瘤 Ⅱ期临床 Knoll pharma. 肿瘤 Ⅱ期临床 ceuticals Genentech 肿瘤 Ⅱ期临床 IL-1ra Antril Synergen AML、CML、炎性肠炎、 Ⅰ/Ⅲ期临床 anakinra 类风湿关节炎、脓毒症、 化脓性休克 FGF Chiron Ophthalmics 角膜与晶体手术 Ⅲ期临床 Ethicon 伤口愈合、皮肤溃疡 Ⅱ期临床 Chiron 伤口愈合、皮肤溃疡 Ⅱ期临床 California 慢性软组织溃疡 Ⅱ期临床 Biotechnolgy bFGF Synergen 静脉郁积、糖尿病的腿足溃疡 胰岛素样生长因 Genentech 营养支持 Ⅱ期临床 子-1(IGF-1) Ⅱ型糖尿病 Ⅰ期临床 Chiron Ⅱ型糖尿病 Ⅱ期临床 PDGF Amgen CIBA-GEIGY Ⅱ型糖尿病 Ⅱ期临床 Amgen 慢性皮肤溃疡 Ⅰ/Ⅱ期临床 Chiron 皮肤溃疡 Ⅱ期临床 Ethicon 皮肤溃疡 Ⅱ期临床 Zymo Genetics 糖尿病溃疡 Ⅰ期临床